孕激素受体对骨量积累的性别依赖效应及成骨细胞阶段特异效应
2017-09-12 文章来源:Journal of Bone and Mineral Research 作者:丁悦 彭芃(中山大学孙逸仙纪念医院骨外科) 点击量:2202 我要说
期刊年卷:Journal of Bone and Mineral Research, Vol. 32, No. 9, September 2017, pp 1841–1852
作者:Zhendong A Zhong,Alexander Kot, Yu-An E Lay, Hongliang Zhang, Junjing Jia, Nancy E Lane, and Wei Yao.
背景介绍
不同性别之间的骨形成和骨丢失具有差异性。相较女性而言,男性的骨峰值(BPM)更高,骨骼尺寸更大。女性进入更年期和衰老期后骨质流失会加速,这主要是由于女性体内雌激素水平下降,从而导致了骨量减少和骨质疏松症发生的风险提高。性激素通过与核激素受体超家族的成员结合从而作用于靶细胞。已经有大量的实验通过全身敲除或者组织特异性敲除的小鼠模型来研究雌激素受体(ER)和雄激素受体(ARs)对骨骼内稳态的作用。例如,在男性骨骼发育期间,雌激素通过雌激素受体α(ERα)刺激骨膜扩张,而雄激素通过雄激素受体(AR)作用于成骨细胞和骨细胞以增加小梁骨形成。然而在女性骨骼发育中,雌激素通过ERa抑制骨膜发生、皮质内骨吸收和软骨细胞重塑,导致骨骺的早期闭合和骨扩张的衰减。
孕激素对骨形成的影响仍未明确,现有研究大多使用孕酮激动剂或拮抗剂来评估其在临床中对骨量的影响。用孕酮激动剂或拮抗剂实验可能会影响其他激素水平,包括雌激素,雄激素和促卵泡激素(FSH)等等。也有研究者选用了高骨量表型的孕激素受体(PR)种系敲除(PRKO)小鼠进行研究。与野生型(WT)小鼠相比,雌性PRKO小鼠的骨形成量较高,而雄性PRKO小鼠的骨吸收量较低。基于已有的报告,我们假设孕激素受体可以直接参与骨形成和骨量积累的调节。实验者分别选用了以下三种能敲除孕激素基因(PRcKO)的骨组织特异性驱动子:Prx1-Cre,其靶向细胞为早期的骨髓间充质干细胞(MSC);Dmp1-Cre,靶向细胞为骨细胞和间充质谱系细胞亚群;骨钙素-Gre(Bglap-Cre),主要靶向细胞为成熟成骨细胞。
实验方法及结果:
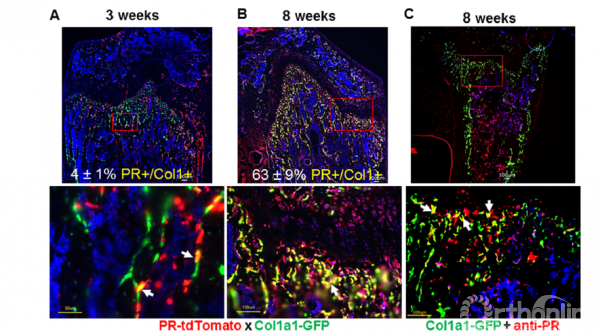

图1
实验者构建了杂交小鼠系以研究孕激素受体在骨组织的分布特征。实验者构建了PR-Cre;Ai14D;Col1a1-GFP小鼠,该小鼠表达孕激素受体的细胞表现出红色荧光,而成骨细胞/骨细胞则显示为绿色荧光。在分化过程中表达孕激素受体的成骨细胞则表现为黄色荧光覆盖。收集3〜8周龄的PR-Cre/Ai14D/Col1-GFP小鼠的右股骨远端;制成冷冻切片。
成骨细胞谱系可表达孕激素受体(PR)基因,特别是在成骨细胞前体中表达明显。实验者在3周龄小鼠远端股骨的骨表面以及生长板软骨区域内观察到孕激素受体(PR)表达所对应的红色荧光。在8周龄时,在生长板,骨内表面和骨髓内可观察到红色荧光(图1A,B)。在海绵状骨表面可观察到,3周龄时有4±1%表达孕激素受体的细胞同时表达为黄色荧光;到8周龄时有63±9%的PR表达细胞同时表达黄色荧光(图1B)。此外,实验者分别取1、2、6月龄的小鼠的远端股骨总蛋白,用蛋白质印迹分析法检测PR蛋白水平。两种性别的小鼠骨组织均主要表达PR-B蛋白,且随着年龄的增长,PR-B蛋白的表达迅速下降(图1D)。收集2个月龄的小鼠的BMSCs,并促进其分化形成成骨细胞,在分化期间的第0,1,2,3和6天收集RNA进行RT-PCR分析。在雌性小鼠中BMSCs开始分化为成骨细胞时,PR表达开始迅速下降。而在雄性小鼠中,PR在早期持续表达(第1至3天),然后随着BMSCs进一步成熟形成成骨细胞而减少(图1E)。实验者从颅骨和骨髓中分离出成骨细胞样群体,在体外用成骨培养基促进其分化形成成骨细胞,并在不同时间点提取RNA。PRmRNA水平在培养第0天时最高,并且随着细胞成骨分化而迅速下降(图1F)。

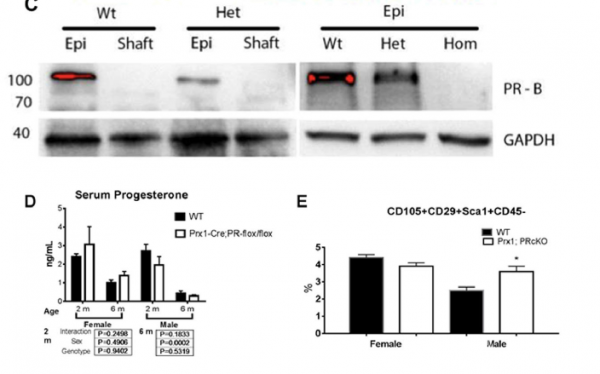
图2
敲除早期骨细胞中的孕激素受体基因(通过Prx1标记),可以提高骨小梁的骨量并促进骨形成,并具有性别特异性。实验者条件性敲除了骨髓间充质干细胞中的PR基因,构建了Prx1;PRcKO小鼠系。Prx1;mT/mG报道模型证实了Prx1-Cre在长骨中的软骨形成细胞和成骨细胞中均有活性。收集野生型小鼠及杂合系(PR-flox/t)或纯合系(PR-flox/flox)Prx1; PRcKO小鼠的股骨蛋白,用蛋白印迹实验分析证实了Prx1;PRcKO小鼠的骨组织已经成功敲除孕激素受体,在股骨轴上检测不到PR表达(图2C)。6月龄的雄性小鼠与同龄雌性小鼠相比,血清孕酮激素水平明显较低。2-6月龄的Prx1;PRcKO小鼠和野生型小鼠(对照组)相比,血清孕酮激素水平没有统计学差异。2月龄的雄性Prx1;PRcKO纯合子小鼠的BMSCs中的间充质干细胞样细胞(CD105tCD29tSca1tCD45–)水平比野生型小鼠的同种细胞水平高40%。(图2E).

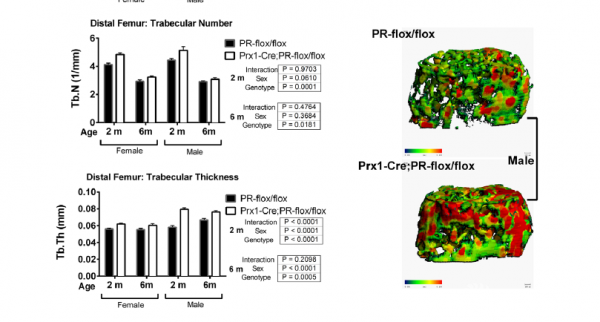
图3
基因敲除小鼠的股骨远端的BV/TV值高于野生型小鼠。两种基因型的老鼠相比,通过mCT测量的股骨中轴骨量或骨骼体积没有差异,通过三点弯曲试验评估的股骨长度和机械性能没有差异。无论何种性别或基因型,小鼠股骨远端的骨小梁骨体积在两个月时均达到峰值,并在之后随着年龄的增长而下降(图3)。在2个月大时,雌性和雄性基因敲除小鼠的股骨远端股骨的BV/TV值分别比野生型小鼠高51.5%和85%,在6个月时,雌性和雄性基因敲除小鼠的股骨远端股骨的BV/TV值均比野生型小鼠高40%。这些增高的比值主要体现在骨量(BV)和骨小梁厚度(Tb.Th)的增加,而不是总体积(TV)增加(图3A,B)。
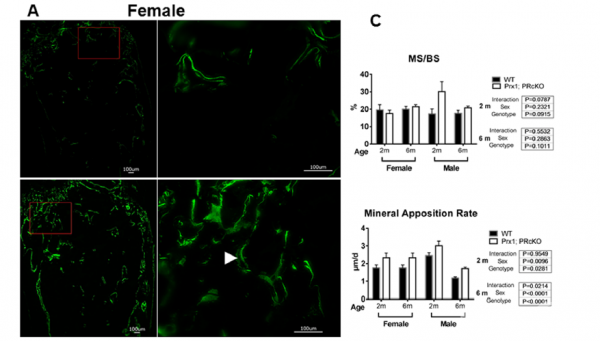
图4
骨形成加快促使Prx1;PRcKO小鼠表现出高骨小梁骨量表型。骨形成动态组织学分析显示,2个月龄大的雌性Prx1;PRcKO小鼠与野生型小鼠相比,矿物结合率显著提高,基于表面的骨形成速率增快,破骨细胞表面积减少。2月龄的雄性基因敲除小鼠与野生型小鼠相比具有较高的矿物结合率和骨形成率。6个月大的雄性Prx1;PRcKO小鼠与野生型小鼠相比具有较高的血清骨钙素,矿物结合率和骨形成率(图4A-C)。通过血清CTX1水平测量的破骨细胞活性水平在突变体小鼠和野生型小鼠之间没有明显差异(图4C)。

图5
为了探究在间质细胞谱系中靶向敲除孕激素受体所引起的高骨小梁骨表型是否具有配体依赖性,实验者在2个月大的野生型小鼠和基因敲除小鼠上进行卵巢切除术或睾丸切除手术。性腺切除术后1个月,由于老化或性腺激素缺乏引起的股骨远端骨小梁骨丢失率在野生型小鼠和Prx1;PRcKO小鼠之间没有差异(雌性小鼠的术后表现为图5A;雄性小鼠的术后表现为图5B)。小鼠在2个月到3个月大时骨皮质约增长5%,但与基因型和激素状态无明显关联(图5C)。
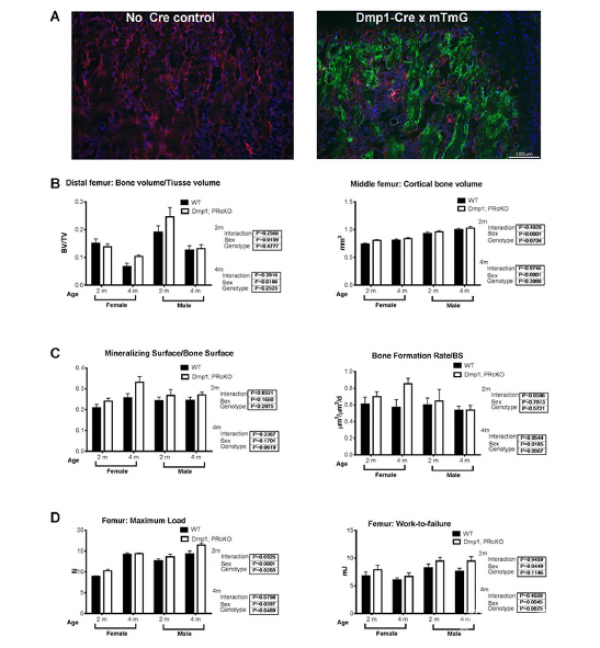
图6
Dmp1-Cre;mT/mG记录模型小鼠条件性敲除骨细胞的孕激素受体后(用Dmp1标记),可以促进骨形成和骨小梁骨量的适度增加。Dmp1标记的细胞包括有骨小梁和骨内膜表面的成骨细胞,破骨细胞和骨细胞(图6A)。这些结果证实了其他关于Dmp1可能标志着骨细胞以外的广泛细胞群体的报告。2个月大和4个月大的突变体小鼠和野生型小鼠的股骨远端骨小梁BV/TV值和股骨中段皮质骨量在不同性别之间有统计学差异,但基因型之间没有明显差别(图6B)。2个月大和4个月大的不同基因型小鼠的动态组织形态学分析显示小梁骨表面的矿化表面和骨形成率没有明显差异(图6C)。破骨细胞表面在不同基因型之间也没有统计学差异。2个月大的雌性Dmp1;PRcKO小鼠的股骨最大负荷量高于野生型;而4个月大的雄性Dmp1;PRcKO小鼠的股骨最大负荷量高于野生型。这些数据表明,Dmp1;PRcKO突变小鼠表现为骨质量适度增加的表型。
条件性敲除成骨细胞中的PR基因(由Bglap标记)不影响小鼠的骨表型和骨转换指标。使用Bglap-Cre驱动剂在成熟成骨细胞和少量软骨细胞中选择性敲除PR,在6个月时不同基因型小鼠远端股骨骨骼质量、骨形成指标(骨钙素)和骨吸收指标(CTX-1)均没有明显差异。成熟成骨细胞中的孕激素受体缺失不会影响骨质量或骨转换指标。
实验结论:
当条件性敲除间充质干细胞(MSC)的孕激素受体基因时,基因敲除小鼠的骨小梁体积增大,矿物结合率增高,骨沉积量增多。可以用骨髓间充质干细胞的数量增加及成骨分化能力增强来解释这一现象。其中雄性小鼠的成骨潜能能力增强较为明显。Prx1;PRcKO小鼠和野生型小鼠的年龄相关性小梁骨丢失率没有明显差异。两种基因型小鼠在快速骨生长期缺乏性激素都会发生快速骨质丢失。使用骨钙素-Cre(Bglap-Cre)在成熟成骨细胞中条件性敲除孕激素受体时,观察到小梁骨质量无明显差异。此外,三种孕激素受体敲除(PRcKO)小鼠的皮质骨质量与野生型小鼠相比均没有差异。总而言之,早期骨祖细胞中的孕激素受体失活能对小梁骨增长造成性别依赖效应,但成熟成骨细胞中孕激素受体失活则对骨量增长没有影响。成骨细胞谱系细胞中的孕激素受体缺失不会影响骨皮层的骨量。


 京公网安备11010502051256号
京公网安备11010502051256号