史建刚:一文读懂腰骶神经弓弦病的诊断与治疗
2018-06-18 文章来源:海军军医大学附属长征医院 史建刚 徐锡明 点击量:6733 我要说
自1829年Smith发明腰椎板切除术治疗椎间盘突出症以来,脊柱外科技术已经历了近200年的发展,由开放、巨创的手术操作逐渐发展到现代微创、精准手术治疗。
随着现代后路椎弓根螺钉内固定技术的发展和普及,虽然复杂脊柱畸形、脊柱肿瘤、脊柱退变、脊柱创伤等均能得到有效外科干预,但同时脊柱外科发展到了一个平台时期。一是对腰腿痛症状主诉重,但目前常规影像学检查难以发现神经损伤征象,难以准确诊断的患者,得不到有效干预和治疗;二是按照常规原则手术治疗后,部分患者会出现神经并发症,甚至足下垂和马尾综合征,但在术中和术后并未发现明确的神经损伤。
针对这两种情况,我们提出了腰骶神经弓弦病概念[1],这同时拉开了脊髓和神经根轴向牵拉损伤疾病诊断和治疗的帷幕。
一、什么是腰骶神经弓弦病
腰骶神经弓弦病指因先天发育性因素、脊柱脊髓退变因素、医源性损伤致腰骶神经牵拉,出现轴性高张力产生一系列神经损伤相关症状。该病可伴有其他腰骶疾病,如椎间盘突出症、椎管狭窄症、腰椎滑脱、脊柱侧凸等。
该类患者硬膜囊和神经根轴向张力增大,且患者腰腿痛症状随张力增大而加重,如同绷紧的琴弦,牵拉力越大,拨动发出的声音越洪亮,而脊柱腰骶部形态恰似一张弓,因此将这类疾病命名为腰骶神经弓弦病。
二、腰骶神经弓弦病的流行病学特点
腰骶神经弓弦病的发病率和自然病程尚缺乏大规模流行病学调查,但是根据我们的经验,至少约有10%的门诊患者疑似弓弦病。
疾病人群一般呈现为三峰分布:第一部分为青春期儿童,于脊柱发育高峰期或高峰期之后1~2年出现,多以腰痛为主要临床表现;第二部分高危人群为青年,多在30岁左右发病,症状逐渐加重,持续多年,该类患者极易忽视,得不到有效干预治疗;最后一个高峰期为中老年,50岁后出现,常合并其他腰椎退变疾病,如椎间盘突出症和椎管狭窄症,这部分患者常按常规退变疾病诊断和治疗,容易出现术后神经损伤并发症,如足下垂、腰腿痛不缓解等。
腰骶神经弓弦病患者是否存在性别、种族差异需要更多临床医生参与研究和调查,目前尚无相关报道。
三、腰骶神经弓弦病的致病机制
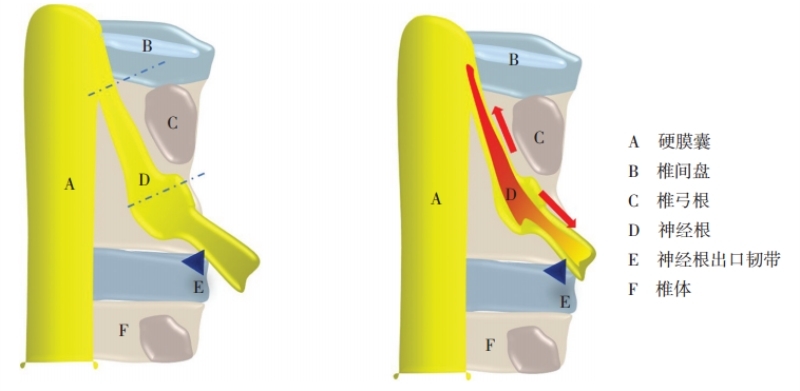
图1 左图为正常神经根走行,两条虚线将神经根分为椎间盘段、侧隐窝段和椎间孔段;右图为弓弦病神经根牵拉示意图,因发育性或退变性因素而导致神经根高张力,同时因椎间孔韧带的锚定作用而导致应力向周围神经传递
腰骶神经弓弦病的病理基础是神经轴向牵拉损伤(图 1)。研究发现,脊髓和神经根具有一定生理弹性[2-4]。Singh等[2]分别采用静态和动态拉力牵拉大鼠腰骶神经根,发现神经根可如橡胶一样被拉长,同时横截面积逐渐减小,呈现一定弹性系数。
电生理监测发现,随着神经根轴向牵拉力增大,神经传导速率逐渐降低,波幅下降,集成动作电位区域变小甚至消失,最终出现神经根传导完全阻滞[3]。牵拉张力不仅可以直接导致神经传导异常,还可以降低神经根血流,引起神经缺血损伤。Kobayashi等[4]研究发现,患者行直腿抬高试验出现放射痛时,L5和S1神经根血流量均下降超过70%。Takamori等[5]术中行直腿抬高试验,发现患者S1神经根肌肉诱发电位和血供均显著降低。
因神经根较外周神经缺少外膜和结缔组织保护,故其抗牵拉能力仅为外周神经的10%,极容易遭受机械损伤[6-7]。尤其是背根神经节细胞,不仅对各种炎症因子、缺血、缺氧敏感,而且更易发生应力损伤[8-10]。
神经根自硬膜囊发出后,经侧隐窝穿出椎间孔。在椎管内神经根可以分为三段,即椎间盘段、椎弓根段和椎间孔[11]。椎间盘段为神经根起始段,硬膜囊形成神经根鞘,此段易受突出椎间盘组织的压迫和牵拉。椎间孔有放射状韧带将神经根固定于根管四壁,形成锚定点,生理状态下这些韧带可以防止外界应力传导至椎管内神经根[12-13];但当神经根出现高张力时,该部位可阻止应力向外周神经分散。神经根椎间盘段和椎间孔的牵拉作用可使椎管内神经根出现高张力,从而引起神经症状。
那么神经根高张力是如何产生的呢?我们发现存在两种不同类型神经轴向牵拉损伤:一种是脊柱和神经组织发育不匹配的青少年型,一种是脊柱和神经组织退变不匹配的中老年型。
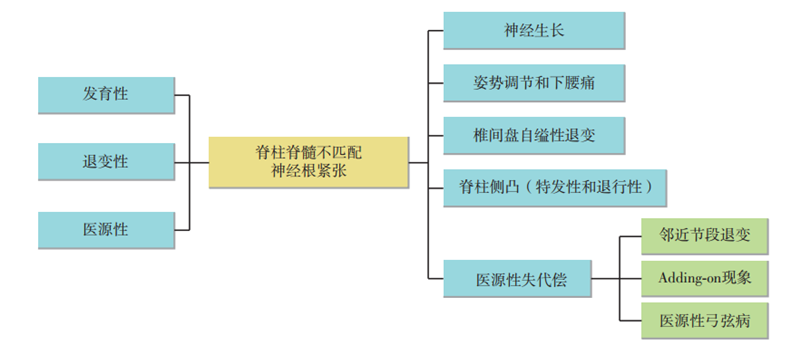
图2 腰骶神经弓弦病的发病机制(失代偿机制),即弓弦病是由于脊柱和脊髓不匹配导致神经根轴向高张力所致,主要分为发育性、退变性和医源性三种类型。当出现神经根高张力时,机体存在如下代偿机制:加快神经生长;姿势调节,如过度代偿则会出现下腰痛;椎间盘自缢性退变,以降低椎间高度;脊柱侧凸和椎体旋转,以缓解一侧神经根张力。同时根据弓弦病理论,可以解释邻近节段退变、adding on现象和医源性弓弦病等相关脊柱医源性失代偿现象
在机体发育时,神经根生长慢于椎体生长,从而出现被动高张力,生理范围内的张力可以促进神经生长[14-16],但张力过大,则会破坏神经的解剖结构和生理功能[17],此即发育性脊柱神经组织不匹配(图 2)。
青少年患者发病多是缘于此机制,追问病史可发现患儿身高突增,年身高增加可达20cm。此外,在脊柱退变、椎间隙丢失的中老年患者中为何仍会出现腰骶神经弓弦病呢?
我们认为神经退变快于椎体退变,老年患者神经根弹性下降,血管壁僵硬,当神经根受到轴向张力时更容易损伤,此即退变性脊柱神经组织不匹配(图 2)。椎间盘和神经根相互影响的“反射弧”机制研究将成为未来研究的一个重点。另外,如忽视脊柱和脊髓的匹配问题以及神经在椎管内的病理状态(即弓弦病)而行常规腰椎手术,则容易发生神经根牵拉。
我们认为,因手术操作不当而致神经根的过度轴性张力是导致医源性脊髓或神经根损害的重要原因(图 2)。
四、腰骶神经弓弦病的诊断
(一)临床症状
腰背部疼痛,持续时间长,病史可绵延数年,平躺和晨起时疼痛,弯腰可加重,难以久坐;双侧或一侧下肢肢体麻木、无力。麻木程度和部位根据轴向张力不同而表现不一,休息可部分缓解,多为双侧表现;严重者可出现会阴部麻木、大小便功能异常。
(二)体格检查
双侧膝关节肌腱反射多为活跃或亢进,如同时伴有严重的腰椎间盘突出症或腰椎管狭窄症,则膝跳反射可以消失或减弱;单侧或双侧直腿抬高试验或股神经牵拉试验阳性;严重患者可出现肛门括约肌肌力下降。
(三)影像学检查
椎管无明显压迫征象(排除颈、胸段病变),腰骶水平位MRI显示存在马尾沉降征阳性。
(四)下肢肌电图检查
双侧下肢神经源性损害电生理表现,具体表现为:神经传导速度检测示MCV和CV减慢、远端潜伏期延长、波幅低于50%等。
(五)术中显示
硬膜囊及神经根轴性紧张,神经剥离子向内侧推拨神经根或硬膜时阻力较大,神经根活动度显著下降,且蠕动减弱。
五、腰骶神经弓弦病的自愈机制
由于弓弦病为脊柱脊髓发育和退变不匹配所致,在发病初期,机体可通过自身代偿恢复脊柱脊髓协调性,阻止疾病进展,恢复神经根张力。根据我们的临床经验和相关研究报道,发现腰骶神经弓弦病可能存在自愈机制[14,18]。
(一)神经生长加快
虽然过度牵拉可以破坏神经结构,但研究发现神经元可适应中、低强度张力[14-16]。
在机体快速生长过程中,神经一直处于张力紧张状态,在关节活动时神经亦可承受超过初始值25%的高张力,而在骨折愈合和行长骨延长术时,神经均能适应一定张力,并处于一个张力环境中[19]。
细胞学实验发现,适度张力可加快神经元再生和轴突生长[20-21]。在体动物实验发现,坐骨神经拉长11%,不但不会引起神经电信号改变,而且会促进神经和髓鞘再生、相关结构蛋白合成。该效应可能与激活mTOR转录因子复合物相关[22]。
(二)脊柱形态改变和下腰痛
当轴向张力超过神经耐受时,机体首先会通过调整脊柱形态来减少神经承受的张力。腰背部肌肉收缩,会增加腰椎前凸角度,降低椎管高度,减少神经根在侧隐窝走行距离,进而部分缓解脊柱脊髓不匹配状态。
患者腰椎前凸增加,导致腰椎关节突压力增加,继而发生关节突增生、关节囊损害、关节突骨关节炎等不同程度的病理变化,而每种病理变化均产生不同特点的下腰痛[18,23]。
因此,青年患者的下腰痛多为腰椎关节突压力改变所致,而老年患者的下腰痛多为关节突病理变化所致。虽然目前有多种假说解释下腰痛发病机制,如椎间盘源性、肌肉劳损、无菌性炎症等,但均难以自圆其说[24]。基于弓弦病理论,我们认为下腰痛是神经根的轴性张力和椎间盘高度在生理反射弧机制下的关节突不同病理变化所致。
(三)椎间盘自缢性退变
当脊柱形态调节难以代偿时,机体会启动椎间盘自缢机制,即巨噬细胞增加,椎间盘组织减少,椎间高度降低,最终缓解神经根张力。
虽然临床弓弦病患者可出现多个椎间盘组织丢失,椎间高度降低,但影像学检查有时并未发现明显的椎间盘突出或脱出,特别是青少年患者。这就是椎间盘自缢性退变理论,也是机体自我修复机制。
椎间盘发生自缢性退变同时,也可伴发其他常见疾病,例如在承受外力情况下瞬间出现椎间盘破坏(椎间盘突出或脱出),从而降低椎间盘高度,缓解神经根张力。术中常发现髓核突出节段的神经根张力较高,说明椎间盘突出或脱出均基于神经根高张力所产生的病理变化;同时也发现退变严重的椎间盘并非为承受力或活动度最大的椎间盘。这也是目前理论难以解释的临床现象。
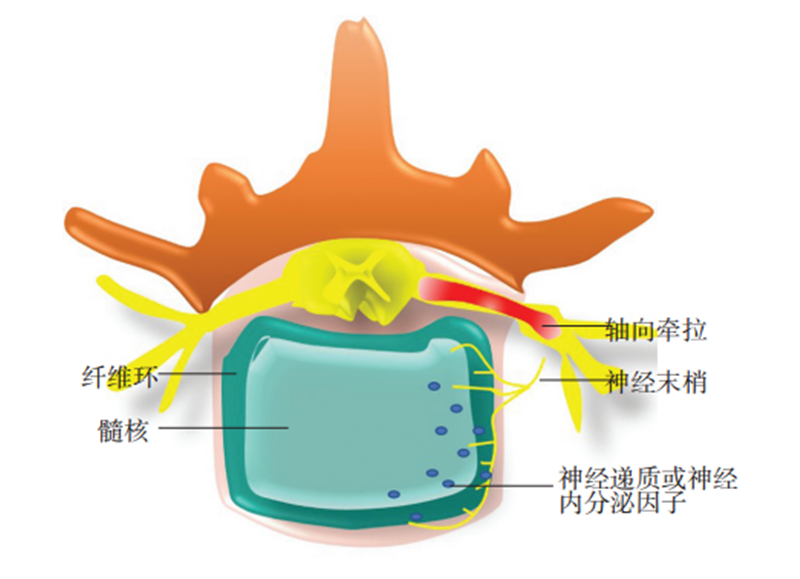
图3 椎间盘自缢性退变示意图,正常髓核无神经末梢支配,而当神经根轴向牵拉时,可以促使神经末梢和神经递质进入髓核,启动髓核自噬,减少细胞外基质合成,加快椎间盘退变,从而降低椎间高度,缓解神经根轴向张力
基于弓弦病理论,我们认为神经根高张力导致了椎间盘自缢,产生了椎间盘巨噬细胞自噬,椎间盘组织消失,椎间隙变窄,椎间高度降低,恢复了神经根自然张力(图 3)。临床发现,有些病例在恢复椎间隙至正常高度后却产生了神经根症状,甚至产生足下垂;也有的病例在切除一侧椎间盘和融合术后产生对侧足下垂。这一临床并发症的产生,有力地证实了上述病理变化的全过程。
(四)特发性脊柱侧凸和椎体旋转
在机体发育过程中,可出现神经根非对称性发育异常,导致神经根张力发生非对称性轴性变化,机体为缓解这一变化,则通过旋转椎体产生侧凸,达到机体自愈。但有的患者随着进一步发育,出现恶性循环,导致严重侧凸,即特发性脊柱侧凸。如侧凸进行性加重,则可能出现失代偿,即凹侧和凸侧双侧神经根高张力。我们发现,脊柱侧凸患者凹侧神经根张力更高,此时需采用神经和软组织松解术进行治疗,否则术后易出现神经并发症。
因此,特发性脊柱侧凸可能是弓弦病机体代偿的重要方式和机制。脊柱快速生长时期,易出现神经根高张力,从而导致侧凸进行性加重。解剖学研究发现,在侧凸患者中,脊柱前柱长度远大于椎管和后柱长度,椎体旋转程度与椎管长度减少呈明显正相关[25]。MRI研究发现,青少年特发性脊柱侧凸患者的椎管/椎体长度比值显著低于正常对照组[26]。这提示,侧凸和椎体旋转可缩短椎管长度,改善椎体对神经根牵拉,缓解神经张力。
(五)退变性侧凸
在中老年患者中,一部分人群神经退变较快,神经根弹性下降,当左右两侧退变不平衡时,会出现一侧神经根张力更高,当脊柱形态调节和椎间盘退变难以代偿时,即会出现退变性脊柱侧凸,以缓解凹侧神经根张力。
这可能是老年发生退变性侧凸的原因,且患者多伴有神经症状。临床研究显示,常规方法治疗退变性侧凸矫形术后易出现严重神经并发症,如足下垂、马尾综合征,然而影像学检查又难以发现神经损害证据[27-28]。这可能是畸形矫正后,机体侧凸对神经根张力的代偿遭到破坏,从而引起术后神经根轴向高张力,产生神经症状。
因此,根据我们的临床经验和弓弦病理论,对老年退变性侧凸的治疗原则是:矫正畸形,以恢复神经根正常张力为标准。侧凸是单侧神经根张力异常所致,故需解决单侧神经根张力异常;而前凸或后凸是双侧神经根张力异常所致,故需解决双侧神经根张力异常。
六、医源性失代偿
(一)相邻节段椎间盘退变
行常规腰椎手术植入大号融合器恢复椎间高度时,椎间孔出口处韧带的锚定作用可致神经根出现高张力。此时,机体为了缓解神经根张力,势必会使神经根起始端下移,即出现内固定上一邻近节段椎间盘退变加快。这也解释了邻椎病为何更易出现在内固定近端节段。
由于远端邻近节段发出的神经根可能位于椎间盘以下的位置,所以对下一邻近节段神经根张力影响较小。目前,学术界对邻椎病的致病原因存在争议,一部分学者认为邻椎病是自然退变状态[29],而另一部分学者认为内固定是导致邻椎病的主要原因[30]。Rao等[31]研究发现,邻椎病与随访时间呈相关性,而与患者年龄、融合节段和矢状位序列无相关性。随着时间延长,处于高紧张状态的神经根弹性下降,对牵拉应力更加敏感,从而导致邻近节段退变更重[28]。
(二)adding on现象
与邻椎病发生机制类似,脊柱畸形矫形过程中如未解除神经根轴向张力,尤其是凹侧撑开后,可加重神经根和硬膜囊紧张,从而致使一侧神经根术后高张力,严重者术后会出现疼痛、下肢麻木,甚至足下垂。在脊柱侧凸矫形术后,随访发现高达21%的患者下端固定椎远端出现与主弯方向一致的新弯,此即adding on现象。
具体表现为术后两年,下端椎向内固定融合节段远端移动,冠状面Cobb角增加5°以上;或下端固定椎远端相邻椎间盘楔形成角5°以上。这将逐步导致内固定矫形效果丢失,严重者需要再次手术。
目前,研究发现adding on现象可能与下固定椎选择不当、侧凸类型、双肩平衡等因素相关[32-34]。作者认为,术后侧凸凹侧持续加重与矫形术未能解除凹侧神经根高张力相关,机体通过新发侧凸以缓解神经根高张力。
(三)医源性弓弦病
由于一些医生对弓弦病认识不足,没有重视神经根所处状态,所以致使术后出现医源性弓弦病。对于下腰痛患者,牵引后症状加重的发生率为7%~31%,甚至有些患者牵引后需要接受手术治疗[35-36]。常规腰椎后路手术后,神经并发症发生率为2%~8%,而大多数患者术后MRI检查却并未发现压迫[37-38]。纽约特种外科医院总结244例行侧方椎间融合术和前方椎间融合术患者,发现7例术后出现对侧下肢运动障碍,作者推测前方椎体撑开、轴向压力增加可能是造成足下垂的主要原因[39]。
脊柱畸形矫正手术也是引起腰骶神经弓弦病的重要病因。根据脊柱侧凸研究协会报告,侧凸术后儿童新发神经损伤率为0.4%~2.0%[40-43],成人为1.8%~3.1%,其中部分患者出现马尾综合征;然而常规影像学检查并未发现压迫或神经损伤[27-28]。脊柱退变、脊柱肿瘤、脊柱畸形术前如果未能考虑神经张力状态,术后容易出现医源性弓弦病。
七、外科治疗
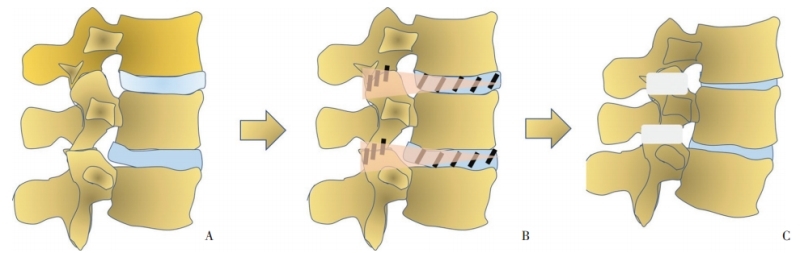
图4 capsule手术示意图A:腰椎解剖模式;图B:切除椎间盘后2/3、部分关节突关节和部分附着于神经根的韧带、棘间韧带;图C:capsule手术后可见椎间盘和关节突已切除,椎间高度降低,腰椎后凸增加,椎管长度均匀缩短
目前,常规腰椎手术的理念是解除神经根横截面压迫,恢复脊柱序列稳定性,然而却忽视了神经根退变状态以及神经轴向张力变化。我院根据脊柱脊髓功能单元解剖关系,开拓性提出神经根轴向松解术——capsule手术(图 4),恢复脊柱脊髓之间的协调性[1]。
脊柱外科手术的目的不仅是恢复脊柱的序列,更重要的是改善神经状态,恢复脊柱脊髓功能单元的协调性,防止神经功能恶化。capsule手术可以通过两方面解除神经根高张力:一方面通过切除椎间盘后2/3和棘间韧带,压缩脊柱后柱,缩短神经根走行距离;另一方面通过部分切除上、下关节突和神经根周围韧带,使张力向外周神经分布。capsule手术同时解除神经根压迫以及轴向张力损伤,其核心理念是恢复神经根的自然状态。
更重要的是,capsule手术通过多节段降低椎间高度,预留神经退变空间,可以提高远期效果。该手术方式特别适用于脊柱侧凸和脊髓栓系综合征等发育相关疾病,以预防疾病进展。
总之,根据腰骶神经弓弦病理论,不仅可解释下腰痛、椎间盘退变、脊柱畸形、退变性侧凸等目前病因未明疾病的发病机制,同时又可指导手术方案,预防术后邻近节段退变、畸形加重、医源性神经损伤等并发症。
目前,针对腰骶神经弓弦病的研究尚处于起步阶段,尤其是通过影像学和实验室进行的诊断研究,进一步确定弓弦病诊断标准,明确神经轴向损伤程度和范围,需要国内外骨科同行齐心聚力,共同攻关。
作者简介

史建刚
主任医师、教授
博士及硕士研究生导师
上海市领军人才
上海市“新百人”
上海长征医院骨科医院脊柱二科主任
学术创新:
• 发明颈椎后纵韧带骨化症ACAF技术
• 发明腰椎脊髓栓系综合征capsule手术技术
• 发明胸腰椎骨质疏松性骨折NICE微创技术
• 提出脊髓栓系综合征“脊柱脊髓发育不匹配”理论
• 提出“腰骶神经弓弦病”概念及致病假说
学术专长:
• 颈椎病、腰椎病的外科治疗及微创治疗
• 重度颈椎后纵韧带骨化症
• 脊柱脊髓发育性畸形(脊髓拴系综合征、半椎体畸形、颈椎畸形等)
• 腰骶神经弓弦疾病
学术任职:
• 中华医学会骨科学分会脊柱学组 委员
• 中国康复医学会脊柱脊髓专业委员会 委员
• 中国医师协会骨科分会脊柱专家组 委员
• 中国人民解放军骨科专业委员会及脊柱学组 委员
• 中国医药教育协会骨科专业委员会 副主任委员
• 中国医药教育协会骨科专业委员会脊柱分会 主任委员
• 《Spine Journal》英文版 编委
• 《Asian Spine Journal》英文版 编委
主要荣誉:
• 发表文章50余篇,SCI40余篇
• 主编专著6部,在编3部
• 获国家、军队及省部级课题10余项
• 获国家、军队及省部级奖项10余项
• 获国家发明及实用新型专利30余项
• 立三等功2次

徐锡明
海军军医大学附属长征医院骨科医院脊柱二科
主治医师、讲师
学术方向:脊柱发育性畸形临床治疗与基础研究,脊柱微创外科
参考文献:
[1]史建刚, 徐锡明, 孙璟川,等. 腰骶神经弓弦病30例诊治分析[J]. 中华医学杂志, 2017, 97(11): 852⁃586. DOI: 10.3760/cma.j.issn.0376⁃2491.2017.11.012.Shi JG, Xu XM, Sun JC, et al. Lumbosacral nerve bowstring dis⁃ease[J]. Natl Med J China, 2017, 97(11): 852⁃586. DOI: 10.3760/cma.j.issn.0376⁃2491.2017.11.012.
[2]Singh A, Lu Y, Chen C, et al. Mechanical properties of spinalnerve roots subjected to tension at different strain rates[J]. J Bio⁃mech, 2006, 39(9): 1669⁃1676.
[3]Singh A, Kallakuri S, Chen C, et al. Structural and functional changes in nerve roots due to tension at various strains and strain rates: an in⁃vivo study[J]. J Neurotrauma, 2009, 26(4): 627⁃640.DOI: 10.1089/neu.2008.0621.
[4]Kobayashi S, Shizu N, Suzuki Y, et al. Changes in nerve root motion and intraradicular blood flow during an intraoperative straight⁃leg⁃raising test[J]. Spine (Phila Pa 1976), 2003, 28(13):1427⁃1434.
[5]Takamori Y, Arimizu J, Izaki T, et al. Combined measurement of nerve root blood flow and electrophysiological values: intraopera⁃tive straight⁃leg⁃raising test for lumbar disc herniation[J]. Spine (Phila Pa 1976), 2011, 36(1): 57 ⁃62. DOI: 10.1097/BRS.0b013e3181ccb1d4.
[6]Luttges MW, Stodieck LS, Beel JA. Postinjury changes in the bio⁃mechanics of nerves and roots in mice[J]. J Manipulative Physiol Ther, 1986, 9(2): 89⁃98.
[7]Beel JA, Stodieck LS, Luttges MW. Structural properties of spinal nerve roots: biomechanics[J]. Exp Neurol, 1986, 91(1): 30⁃40.
[8]DeLeo JA, Winkelstein BA. Physiology of chronic spinal pain syn⁃dromes: from animal models to biomechanics[J]. Spine (Phila Pa 1976), 2002, 27(22): 2526⁃2537.
[9]Hanai F, Matsui N, Hongo N. Changes in responses of wide dy⁃namic range neurons in the spinal dorsal horn after dorsal root or dorsal root ganglion compression[J]. Spine (Phila Pa 1976), 1996,21(12): 1408⁃1414; discussion 1414⁃1415.
[10]Matsuda H, Tsai CL, Tseng CY, et al。Neurophysiologic changes after preganglionic and postganglionic nerve⁃root constriction: an experimental study in the rat[J]. Spine (Phila Pa 1976), 2007, 32(9): 950⁃958.
[11]Ciric I, Mikhael MA, Tarkington JA, et al. The lateral recess syn⁃drome. A variant of spinal stenosis[J]. J Neurosurg, 1980, 53(4):433⁃443.
[12]Spencer DL, Irwin GS, Miller JA. Anatomy and significance of fix⁃ation of the lumbosacral nerve roots in sciatica[J]. Spine (Phila Pa 1976), 1983, 8(6): 672⁃679.
[13]Wiltse LL, Fonseca AS, Amster J. et al. Relationship of the dura, Hofmann's ligaments, Batson's plexus, and a fibrovascular mem⁃brane lying on the posterior surface of the vertebral bodies and at⁃taching to the deep layer of the posterior longitudinal ligament.An anatomical, radiologic, and clinical study[J]. Spine (Phila Pa 1976), 1993, 18(8): 1030⁃1043.
[14]Boyd BS, Puttlitz C, Gan J, et al. Strain and excursion in the rat sciatic nerve during a modified straight leg raise are altered after traumatic nerve injury[J]. J Orthop Res, 2005, 23(4): 764⁃770.
[15]Weiss P. Nerve patterns: the mechanics of nerve growth. Growth,1941, 5: 163⁃203.
[16]Pfister BJ, Iwata A, Meaney DF, et al. Extreme stretch growth of integrated axons[J]. J Neurosci, 2004, 24(36): 7978⁃7983.
[17]Kwan MK, Wall EJ, Massie J, et al. Strain, stress and stretch of peripheral nerve. Rabbit experiments in vitro and in vivo[J]. Acta Orthop Scand, 1992, 63(3): 267⁃272.
[18]Juch JNS, Maas ET, Ostelo RWJG, et al. Effect of Radiofrequency Denervation on Pain Intensity Among Patients With Chronic Low Back Pain: The Mint Randomized Clinical Trials[J]. JAMA, 2017,318(1): 68⁃81. DOI: 10.1001/jama.2017.7918.
[19]Ikeda K, Tomita K, Tanaka S. Experimental study of peripheral nerve injury during gradual limb elongation[J]. Hand Surg, 2000,
5(1): 41⁃47.
[20] Chuang TH, Wilson RE, Love JM, et al. A novel internal fixator device for peripheral nerve regeneration[J]. Tissue Eng Part C Methods,2013, 19(6): 427⁃437. DOI: 10.1089/ten.TEC.2012.0021.
[21]Loverde JR, Ozoka VC, Aquino R, et al. Live imaging of axon stretch growth in embryonic and adult neurons[J]. J Neurotrauma,2011, 28(11): 2389⁃2403. DOI: 10.1089/neu.2010.1598.
[22]Love JM, Bober BG, Orozco E, et al. mTOR regulates peripheral nerve response to tensile strain[J]. J Neurophysiol, 2017, 117(5):2075⁃2084. DOI: 10.1152/jn.00257.2016.
[23]Lee CH, Chung CK, Kim CH. The efficacy of conventional radio⁃frequency denervation in patients with chronic low back pain orig⁃inating from the facet joints: a meta⁃analysis of randomized con⁃trolled trials[J]. Spine J, 2017, 17(11): 1770⁃1780. DOI: 10.1016/j.spinee.2017.05.006.
[24]Massimo A, Silvana M, Fabiana S, et al. Mechanisms of low back pain: a guide for diagnosis and therapy[J]. F1000 Research, 2016,5:1530. DOI: 10.12688/f1000research.8105.2.
[25]Porter RW. Idiopathic scoliosis: the relation between the vertebral canal and the vertebral bodies[J]. Spine (Phila Pa 1976), 2000, 25 (11): 1360⁃1366.
[26]Lao LF, Shen JX, Chen ZG, et al. Uncoupled neuro ⁃osseous growth in adolescent idiopathic scoliosis? A preliminary study of 90 adolescents with whole⁃spine three⁃dimensional magnetic reso⁃nance imaging[J]. Eur Spine J, 2011, 20(7): 1081 ⁃1086. DOI:10.1007/s00586⁃010⁃1471⁃1.
[27]Sansur CA, Smith JS, Coe JD, et al. Scoliosis research society morbid⁃ity and mortality of adult scoliosis surgery[J]. Spine (Phila Pa 1976),2011, 36(9): E593⁃597. DOI: 10.1097/BRS. 0b013e3182059bfd.
[28]Bach K, Ahmadian A, Deukmedjian A, et al. Minimally invasivesurgical techniques in adult degenerative spinal deformity: a sys⁃tematic review[J]. Clin Orthop Relat Res, 2014, 472(6): 1749 ⁃1761. DOI: 10.1007/s11999⁃013⁃3441⁃5.
[29]Wang H, Ma L, Yang D, et al. Incidence and Risk Factors of Post⁃operative Adjacent Segment Degeneration Following Anterior De⁃compression and Instrumented Fusion for Degenerative Disorders of the Cervical Spine[J]. World Neurosurg, 2017, 105: 78 ⁃85.DOI: 10.1016/j.wneu.2017.05.094.
[30]Pesce A, Wierzbicki V, Piccione E, et al. Adjacent segment pa⁃thology: natural history or effect of anterior cervical discectomy and fusion? A 10⁃year follow⁃up radiological multicenter study us⁃ing an evaluation scale of the ageing spine[J]. Eur J Orthop Surg Trau⁃matol, 2017, 27(4): 503⁃511. DOI: 10.1007/s00590⁃017⁃1936⁃6.
[31]Rao RD, Gore DR, Tang SJ, et al.Radiographic Changes in the Cervical Spine Following Anterior Arthrodesis: A Long ⁃Term Analysis of 166 Patients[J]. J Bone Joint Surg Am, 2016, 98(19):1606⁃1613.
[32]Pereira EAC, Oxenham M, Lam KS. Intraspinal anomalies in early⁃onset idiopathic scoliosis[J]. Bone Joint J, 2017, 99⁃B(6): 829⁃833. DOI: 10.1302/0301⁃620X.99B6.BJJ⁃2016⁃1159.R1.
[33]Lee CS, Hwang CJ, Lee DH, et al. Five major controversial issues about fusion level selection in corrective surgery for adolescent id⁃iopathic scoliosis: a narrative review[J]. Spine J, 2017, 17(7):1033⁃1044. DOI: 10.1016/j.spinee.2017.03.020.
[34]Yang C, Li Y, Yang M, et al. Adding⁃on Phenomenon After Sur⁃gery in Lenke Type 1, 2 Adolescent Idiopathic Scoliosis: Is it Pre⁃dictable? [J]. Spine (Phila Pa 1976), 2016, 41(8): 698⁃704. DOI:10.1097/BRS.0000000000001303.
[35]Ajimsha MS, Daniel B, Chithra S. Effectiveness of myofascial re⁃lease in the management of chronic low back pain in nursing pro⁃fessionals[J]. J Bodyw Mov Ther, 2014, 18(2): 273 ⁃281. DOI:10.1016/j.jbmt.2013.05.007.
[36]Wegner I, Widyahening IS, van Tulder MW, et al. Traction for low⁃back pain with or without sciatica[J]. Cochrane Database Syst Rev, 201(8): CD003010. DOI: 10.1002/14651858.CD003010.
[37]Okuda S, Miyauchi A, Oda T, et al. Surgical complications of pos⁃terior lumbar interbody fusion with total facetectomy in 251 pa⁃tients[J]. J Neurosurg Spine, 2006, 4(4): 304⁃309.
[38]Periasamy K, Shah K, Wheelwright EF. Posterior lumbar inter⁃body fusion using cages, combined with instrumented posterolater⁃al fusion: a study of 75 cases[J]. Acta Orthop Belg, 2008, 74(2):240⁃248.
[39]Taher F, Hughes AP, Lebl DR, et al. Contralateral motor deficits after lateral lumbar interbody fusion[J]. Spine (Phila Pa 1976), 2013, 38(22): 1959⁃1963. DOI:10.1097/BRS.0b013e3182a463a9.
[40]Lykissas MG, Aichmair A, Widmann R, et al. Paresis of the L5 nerve root after reduction of low ⁃grade lumbosacral dysplastic spondylolisthesis: a case report[J]. J Pediatr Orthop B, 2014, 23 (5): 461⁃466. DOI: 10.1097/BPB.0000000000000071.
[41]Reames DL, Smith JS, Fu KM, et al. Complications in the surgical treatment of 19,360 cases of pediatric scoliosis: a review of the Scoliosis Research Society Morbidity and Mortality database[J].Spine (Phila Pa 1976), 2011, 36(18): 1484⁃1491. DOI: 10.1097/ BRS.0b013e3181f3a326.
[42]Sharma S, Wu C, Andersen T, et al. Prevalence of complications in neuromuscular scoliosis surgery: a literature meta ⁃analysis from the past 15 years[J]. Eur Spine J, 2013, 22(6): 1230⁃1249.DOI: 10.1007/s00586⁃012⁃2542⁃2.
[43]Fu KM, Smith JS, Polly DW, et al. Morbidity and mortality associ⁃ated with spinal surgery in children: a review of the Scoliosis Re⁃search Society morbidity and mortality database[J]. J Neurosurg Pediatr, 2011, 7(1): 37⁃41. DOI: 10.3171/2010.10.PEDS10212.


 京公网安备11010502051256号
京公网安备11010502051256号