FOXP1在骨骼老化过程中调控间充质干细胞的定型和衰老
2017-09-06 文章来源:The Journal of Clinical Investigation 作者:丁悦 房桂彬 点击量:3299 我要说
背景介绍
成骨细胞转化成脂肪细胞的过程总伴随着间充质干细胞自我更新能力的下降,这是骨髓中老化的间充质干/祖细胞的特征之一。然而,在老化过程中这些细胞活动是如何调控的尚未完全明确。骨老化导致骨量减少及骨髓脂肪增加,是原发性骨质疏松症的主要危险因素。与幼稚细胞相比,衰老的间充质干细胞自我更新能力较差,主要分化成脂肪细胞而不是成骨细胞。间充质干细胞的这种成骨或脂肪形成由几个关键转录因子控制,例如,PPARγ和CEBPα/β/δ构成了脂肪细胞程序的基本级联,而RUNX2和Osterix是成骨细胞分化的主要调节剂。细胞衰老(不可逆生长停滞状态)主要由p16INK4A / Rb和p19ARF / p53途径控制。 p16INK4A是许多成熟干细胞,包括骨髓间充质干细胞的年龄相关性衰退所必需的分子。叉头样转录因子3(FOXP1)是控制多种细胞分化通路的转录因子,人类FOXP1单倍体不足导致颅面结构畸形和言语能力缺陷。间充质细胞干细胞中Foxp1基因缺陷会导致典型的过早的骨老化。这些结果表明年龄依赖性骨质流失在间充质细胞干细胞分化和衰老过程中可能部分地被FOXP1的多方面作用编排。
方法
用分子学和基因学方法去研究叉头样转录因子3(FOXP1)在间充质干细胞衰老的转录调控中所起的作用。利用流式细胞术筛选,避免体外培养的间充质干细胞的异质性。通过Foxp1fl/fl与Prx1-Cre杂交在早期骨髓间充质干细胞中特异性地将其灭活。H&E染色、微计算机断层摄影(μCT)分析及锇染色显示骨髓中脂肪组织的富集情况。成骨细胞特异性转录产物(Alp,Col1a1)和脂肪细胞相关标志物(Pparg, Cebpa, and Fabp4)用于鉴别成脂、成骨分化。通过逆转录病毒转导使C3H10T1/2间充质细胞中的Foxp1持续过表达。我们制作了Nestin-Cre Foxp1fl/fl条件性敲除小鼠,诱发早发性衰老的特征性表现。荧光素酶(Luc)报告实验用于FOXP1-CEBPβ/δ复合体与Pparg转录的关系。在FOXP1缺乏的骨髓间充质干细胞中再敲除 p16INK4A,可部分缓解细胞复制能力的下降和改善骨量。启动子占用分析和荧光素酶报告试验显示,FOXP1直接抑制p16INK4A的转录。我们还进一步研究了Foxp1 and p16INK4A双重缺失的条件性敲除小鼠的表型。碱性磷酸酶、油红O染色以及成骨标志物(ALP, COL1A1, HEY1 and HEYL)的qPCR、成脂肪标志物(PPARγ and FABP4)的Western Blot用于检测人间充质祖细胞的成脂-成骨分化。
结果
骨髓间充质干细胞中的Foxp1表达随着年龄增加而减退。我们检测了骨髓间充质细胞干细胞中4个亚型中的3个:FOXP1 A、FOXP1 D、FOXP1C,发现小鼠发育过程中Foxp1的表达逐渐下降。我们通过流式细胞术筛选来避免体外培养的间充质干细胞的异质性,验证了1个月和18个月大的小鼠骨髓中FOXP1 3种亚型中都出现表达下降(图1)。而不同年龄小鼠的间充质细胞干细胞中的Foxp1水平与细胞衰老标记物p16INK4A水平呈反向相关性(图2)。同时,在1至12个月小鼠的间充质细胞干细胞中,近端Foxp1启动子(核苷酸-196至+1)内CpG岛的DNA甲基化频率几乎翻了一倍(29%-58%)。
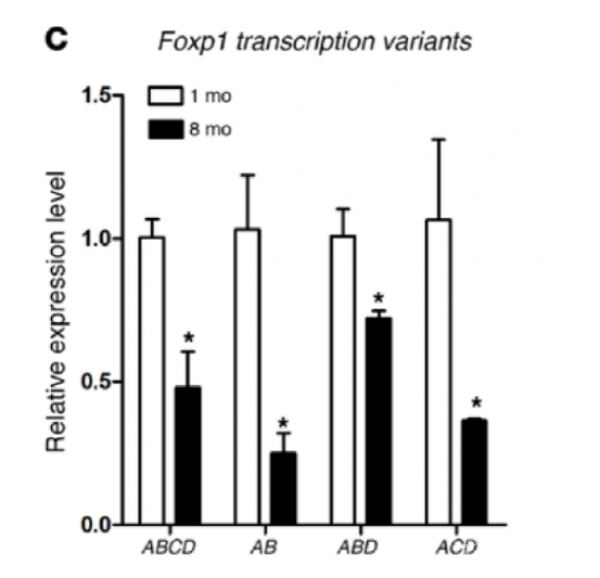
Figure 1
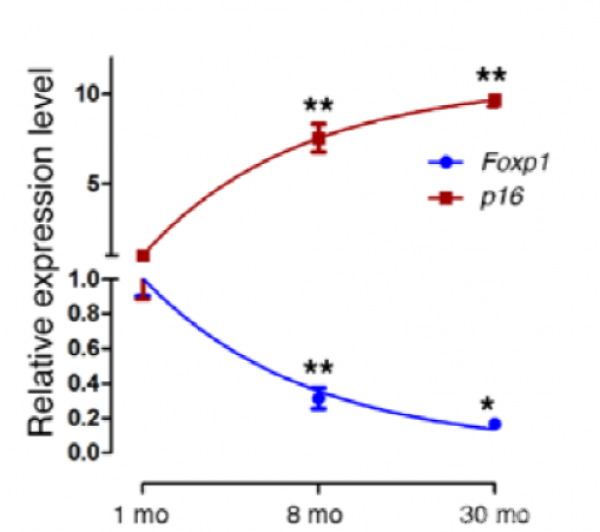
Figure 2
间充质干细胞中Foxp1基因敲除导致了年龄依赖性骨质流失。为了探究FOXP1在间充质干细胞分化和衰老中的作用,我们通过Foxp1fl/fl与Prx1-Cre杂交在早期骨髓间充质干细胞中特异性地将其灭活(Foxp1Prx1Δ/Δ)。H&E染色、微计算机断层摄影(μCT)分析及锇染色显示Foxp1Prx1Δ/Δ突变体的骨髓中脂肪组织相对富集(图3)。μCT分析进一步表明,Foxp1Prx1Δ/Δ小鼠在6,12和16个月大时与Foxp1fl / fl对照组相比较显示出与年龄相关的骨质流失,与骨矿物质密度(BMD)和小梁骨数量逐渐减少所证实的结果一致。组织形态计量分析显示,突变体中每毫米小梁骨表面的成骨细胞减少。总的来说, Foxp1缺陷的骨骼显示出过早老化的相关特性。
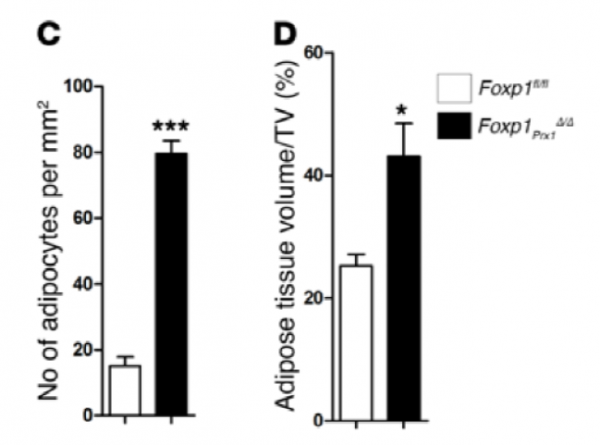
Figure 3
Foxp1调节间充质干细胞分化成脂肪细胞和成骨细胞的潜力。在成纤维细胞集落形成单位(CFU-F)诱导后14天内,Foxp1Prx1Δ/Δ脂肪细胞集落形成单位(Ad-CFU)的数量显著增加,而突变的成骨细胞集落形成单位(Ob-CFU)的数量相对于对照组有所降低,且检测发现成骨细胞特异性转录产物(Alp,Col1a1)平行下调而脂肪细胞相关标志物(Pparg, Cebpa, and Fabp4)上调。
接着我们通过逆转录病毒转导使C3H10T1/2间充质细胞中的Foxp1持续过表达。通过油红O染色和碱性磷酸酶(ALP)染色评估细胞分化发现,Foxp1的强制表达使成骨分化显著提高,而脂肪形成分化下降。接下来,我们用FOXP1逆转录病毒转染原代间充质干细胞,并通过Cebpa, Pparg, Fabp4(成脂标志物)/Runx2, Alp, Col1a1, Osterix(骨标志物)的染色和表达来检查细胞分化,我们再次观察到FOXP1促进间充质干细胞的成骨分化(图4)。
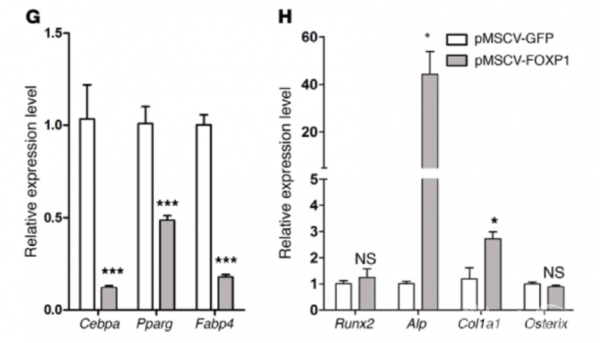
Figure 4
为了进一步确认Foxp1在间充质干细胞分化中的作用,我们制作了Nestin-Cre Foxp1fl/fl条件性敲除小鼠(Foxp1NesΔ/Δ)。Foxp1NesΔ/Δ突变小鼠在骨生长中展示出比Foxp1Prx1Δ/Δ小鼠远更严重的缺陷。在Foxp1NesΔ/Δ突变体中,骨形成受损而脂肪组织富集,脂肪细胞和成骨细胞集落形成单位随着间充质干细胞分化数量改变,且PPARγ及其下游的靶基因Fabp4表达水平提高,证实了间充质干细胞成骨和脂肪形成的潜能呈相似的改变。
间充质干细胞的脂肪形成分化是由转录因子CEBPβ/δ、CEBPα,和PPARγ的序贯激活程序来启动。通过免疫共沉淀(co-IP)试验我们观察到FOXP1与3T3-L1细胞和骨髓间充质干细胞中的CEBPβ and CEBPδ相互作用,来控制脂肪细胞和成骨细胞分化。CEBPα和CEBPβ/δ在最终的脂肪细胞分化中在上游起作用从而诱导过氧化物酶体增殖物激活受体(Pparg)转录。C3H10T1/2细胞中的荧光素酶(Luc)报告实验显示,CEBPα 或 CEBPβ/δ对Pparg-Luc的反式激活都被FOXP1抑制。相反,与对照组相比,PPARγ 和FABP4在Foxp1缺陷的间充质干细胞的表达相对提高。ChIP-PCR显示,FOXP1结合位点位于Pparg转录起始位点上游1112 bp。FOXP1牢固地与该位点结合,直接抑制Pparg转录。与该解释相一致的是,随着C3H10T1/2 细胞的脂肪细胞分化,FOXP1的过表达抑制Pparg和Fabp4的转录。总的来说,我们的发现表明FOXP1-CEBPβ/δ复合体减弱Pparg转录,从而抑制间充质干细胞的脂肪细胞分化。
免疫球蛋白κJ区的Notch /重组信号结合蛋白(RBPjk)信号通过抑制成骨细胞分化维持间充质干细胞同一性。通过免疫共沉淀,我们在C3H10T1 / 2间充质细胞和骨髓间充质干细胞中都检测到FOXP1与RBPjκ的相互作用,FOXP1和RBPjκ蛋白在C3H10T1/2细胞核共表达。接着,我们发现FOXP1利用Notch蛋白的胞内区抑制RBPJk-Luc的激活。此外,Foxp1Prx1Δ/Δ骨髓间充质干细胞表现出对Hey1和Heyl(Hey1和Heyl是Notch信号的两个核心下游作用位点)更高的抑制。这些发现说明FOXP1在出生后的骨老化过程中通过抑制Notch信号,能促进间充质干细胞的成骨分化。
Foxp1通过抑制p16 INK4A转录,从而延缓间充质干细胞的衰老。从Foxp1基因缺陷骨髓中分离出来的间充质干细胞中,细胞周期抑制因子p16INK4A、p21、andp27的表达水平相对提高。然而,成纤维细胞集落形成单位克隆数在6个月时开始逐渐下降,与Foxp1基因敲除导致的自我更新能力下降一致。细胞衰老标记物p16INK4A的表达水平也显著提高。但在Foxp1缺陷的间充质干细胞中,其它2个衰老相关的标记物H3K9me3和LAP2β的表达是下降的。高分辨率免疫组化和Western Blot证实,在Foxp1基因缺陷间充质干细胞中细胞核内LAP2β分布减少。这些体内外实验表明,Foxp1基因缺陷的间充质干细胞的自我更新能力下降。这反过来又导致DNA损伤的快速积累以及扩增中的过早衰老。启动子占用分析识别出了p16INK4A启动子(–1701 to-1695)内的FOXP1结合位点。荧光素酶报告试验显示,FOXP1抑制野生型p16INK4A的活性,而不能抑制突变型p16INK4A报告基因的活性(图5)。这些发现表明,FOXP1通过抑制骨老化过程中的p16INK4A的转录,从而延缓间充质干细胞的衰老。
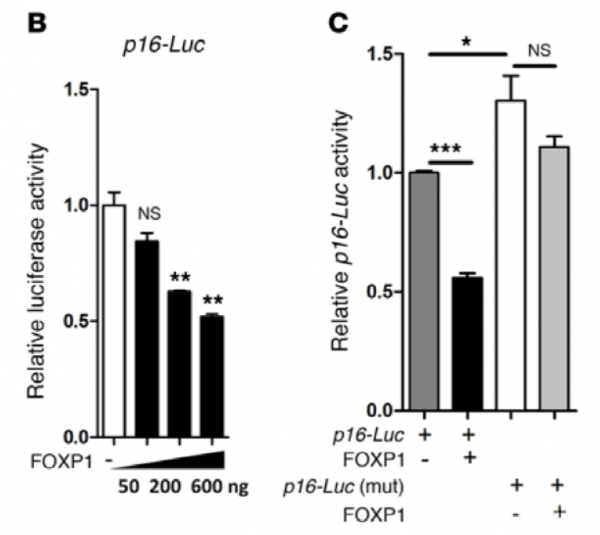
Figure 5
为了进一步检验这个假设,我们研究了Foxp1 and p16INK4A双重缺失的条件性敲除小鼠的表型。我们发现在Foxp1Prx1Δ/Δ p16–/–双重突变小鼠体内,间充质干细胞的复制能力得到部分保留。骨参数μCT分析表明,与单Foxp1Prx1Δ/Δ突变个体相比,双重突变小鼠的骨小梁在体积、数量及骨矿物质密度上显著增加。这些结果表明,p16INK4A敲除部分弥补了Foxp1基因缺陷的间充质干细胞复制能力的不足。
我们探究了FOXP1的过表达是否能够延缓人间充质祖细胞(hMPCs)的衰老。通过群体倍增测定评估发现,来源于27-82岁两性志愿者的人间充质祖细胞内慢病毒FOXP1的过表达能显著地提高其复制能力。我们甚至发现,来自一个74岁志愿者的hMPCs内FOXP1的过表达将其扩增能力提高到与来自一个27岁志愿者的hMPCs相当的水平。在FOXP1过表达的第五代hMPCs中,也可见p16INK4A转录的强烈抑制。碱性磷酸酶、油红O染色以及成骨标志物(ALP, COL1A1, HEY1 and HEYL)的qPCR、成脂肪标志物(PPARγ and FABP4)的Western Blot共同证实:转导了Foxp1基因的hMPCs成骨潜能提高而脂肪形成潜能下降。总的来说,我们的发现表明人间充质祖细胞中FOXP1的过表达使其复制能力增强(图6)。
Figure 6
结论
FOXP1为骨骼衰老期间间充质干细胞衰老和分化能力的剂量依赖性调控分子,幼稚间充质干细胞内高水平的FOXP1表达能防止其过早衰老,导致骨形成超过脂肪形成。在成熟间充质干细胞,FOXP1水平的下降使得p16INK4A转录和脂肪形成的负调节减弱,从而导致间充质干细胞老化。Foxp1启动子区内的DNA甲基化随着年龄增加,从而潜在地促进Foxp1表达的逐渐下调。FOXP1直接抑制间充质干细胞中的Pparg转录,防止老化骨中脂肪增多。 FOXP1可能会通过抑制Notch信号传导限制间充质干细胞的成骨潜能。总的来说,FOXP1通过控制间充质干细胞分化过程中的成脂-成骨平衡,成为老化的关键效应器。成熟hMPCs中FOXP1表达的升高逆转了其扩增能力和成骨潜能的下降。目前用于骨质疏松症的合成代谢靶点,如甲状旁腺激素(PTH)或Wnt激动剂,主要促进骨形成中的成骨细胞形成。 FOXP1在调节间充质干细胞可塑性和衰老过程中的多重作用,使其成为骨质疏松症治疗的潜在合成代谢靶点。
本研究的主要发现是FOXP1可以通过直接调节p16INK4A转录来减缓间充质干细胞的老化。 与此相关的是,FOXP1过度表达与多种癌症有关。 鉴于衰老状态可以保护细胞免于向癌症发展,该研究结果可能有助于了解多种肿瘤发生的FOXP1相关机制,但仍需要进一步的研究来解决FOXP1 / p16级联如何保护多种细胞谱系免于过早衰老或无限过度生长。
来源:The Journal of Clinical Investigation
期刊年卷:J. Clin. Invest. 2017 Apr 03 ;127(4)
作者:Hanjun Li, Pei Liu, Shuqin Xu, Yinghua Li, Joseph D. Dekker, Baojie Li, Ying Fan, Zhenlin Zhang, Yang Hong, Gong Yang, Tingting Tang, Yongxin Ren, Haley O. Tucker, Zhengju Yao, and Xizhi Guo


 京公网安备11010502051256号
京公网安备11010502051256号