NCCN®2015肿瘤学临床指南——骨肿瘤
2017-03-22 文章来源:骨科在线编委 甘肃省肿瘤医院骨与软组织肿瘤科 宋建民 译 我要说
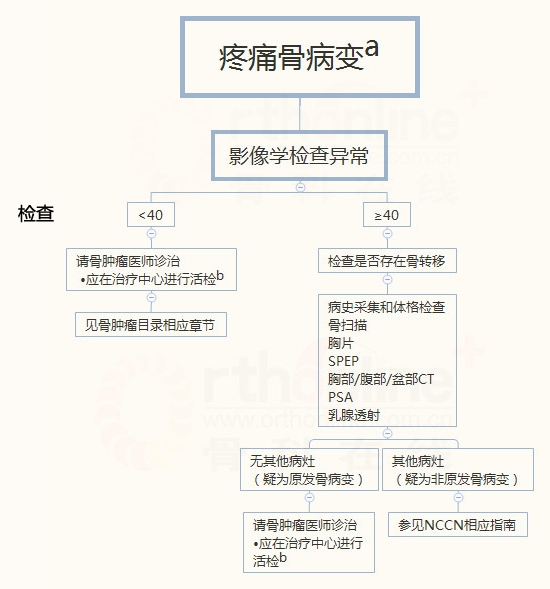
a 无痛骨病变需要肌肉骨骼影像学专家进行评估,并转由多学科小组诊治。见多学科小组(BONE-A)。
b 见骨肿瘤治疗原则(BONE-B)。
BONE-1
软骨肉瘤

a 见多学科团队(BONE-A)
b 见骨肿瘤治疗原则(BONE-B)
b 对于软骨肉瘤的分级仍有争议,局部治疗需要考虑病史、影像学特征、肿瘤大小及生长位置
d 不论是保肢术还是截肢术,均需达到组织学上阴性切缘
e 见放疗原则(BONE-D)
f Bernstein-Molho R, Kollender Y, Issakov J, et al. Clinical activity of mTOR inhibition
in combination with cyclophosphamide in the treatment of recurrent unresectable
chondrosarcomas. Cancer Chemother Pharmacol. 2012;70(6):855-860.
CHON-1
脊索瘤

a 见多学科团队(BONE-A)
b 见骨肿瘤治疗原则(BONE-B)
c 影像学检查完成后需行病理活检,活检方式由解剖位置决定,活检最好由专业的肿瘤治疗中心执行。
CHOR-1
脊索瘤

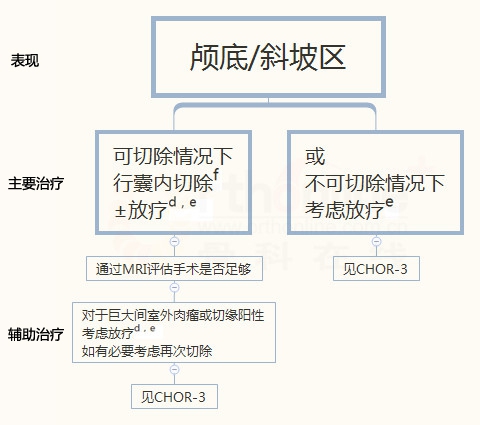
b 见骨肿瘤治疗原则(BONE-B)
d 术前、术中和/或术后可以给予放疗
d 见放疗原则(BONE-D)
f 推荐在适当情况下行最大限度减瘤
CHOR-2
脊索瘤

b 见骨肿瘤治疗原则(BONE-B)
e 见放疗原则(BONE-D)
g 见骨肿瘤全身治疗药物(BONE-C)
CHOR-3
尤文氏肉瘤家族
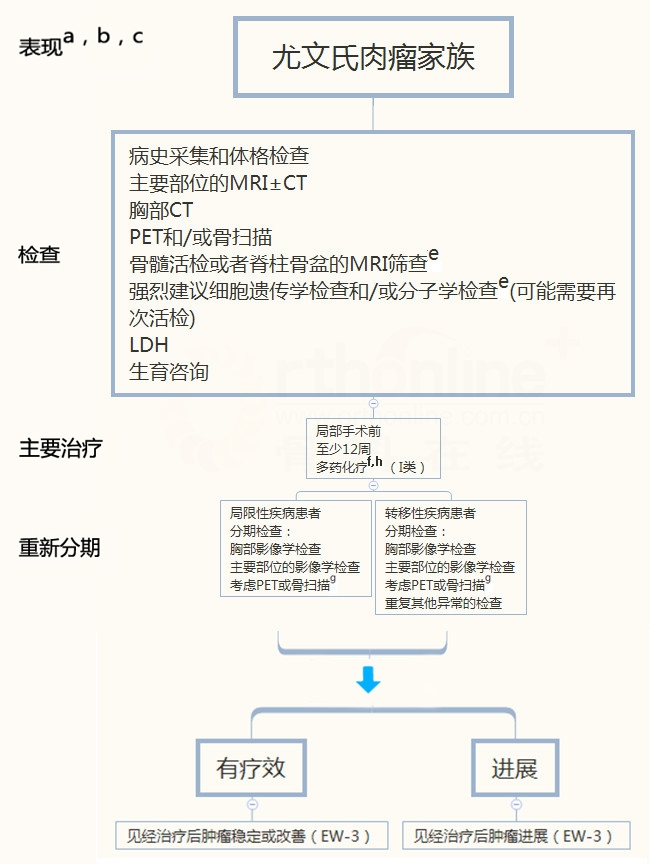
a 见多学科团队(BONE-A)
b 见骨肿瘤治疗原则(BONE-B)
c 对尤文肉瘤肿瘤家族的任何成员可以使用该原则处理,包括骨的原始神经外胚层肿瘤,Askin瘤,和骨外尤文氏肉瘤
d Kumar J, Seith A, Kumar A, et al. Wholebody MR imaging with the use of parallel imaging for detection of skeletal metastases in pediatric patients with small cell neoplasms: comparison with skeletal scintigraphy and FDG PET/CT. Pediatr Radiol 2008;38:953-962. Epub 2008 Jul 18.
e 90%的尤文氏肉瘤家族会有特定的细胞遗传学易位
f 见骨肿瘤全身治疗药物(BONE-C)
g 在初步检查后,使用相同的影像学检查
h 基于肿瘤的反应,转移性疾病患者可以考虑较长时间的初始治疗
EW-1
尤文氏肉瘤家族
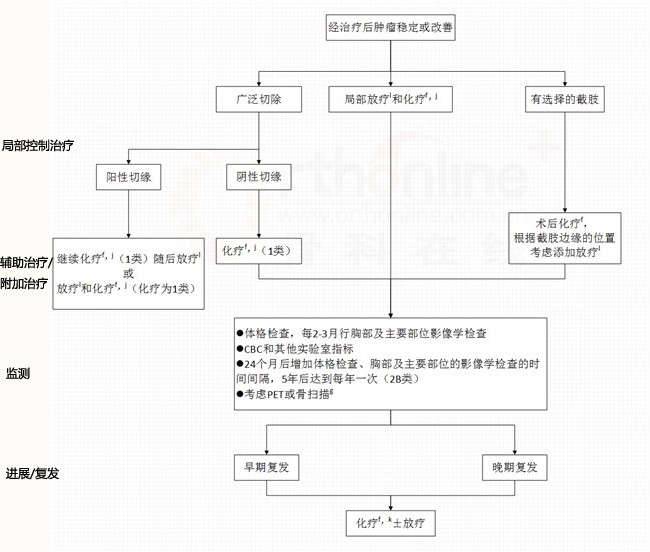

f 见骨肿瘤全身治疗药物(BONE-C)
g 在初步检查后,使用相同的影像学检查
I 在切缘不足的情况下考虑放疗
j 1类证据表明,根据化疗方案给予24-49周化疗
k 对于晚期复发,考虑用以前有效的方案重新治疗
l 见放疗原则(BONE-D)
EW-1
骨巨细胞瘤

a 甲状旁腺功能亢进引起的棕色瘤,需要作为一个鉴别诊断
b 见骨肿瘤治疗原则(BONE-B)
GCTB-1
骨巨细胞瘤
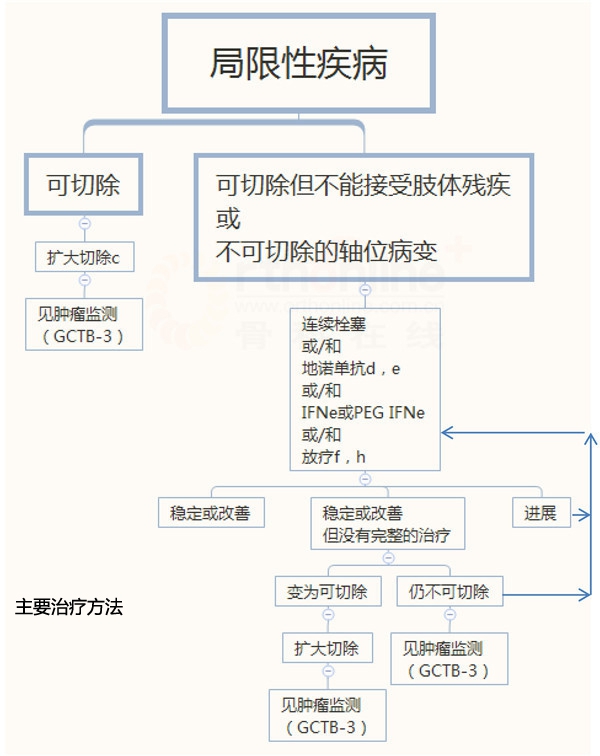
c 囊内切除联合有效的辅助手段,这一方法是合适的
d 对有效的患者,地诺单抗可以持续使用直至肿瘤进展
e 见骨肿瘤全身治疗药物(BONE-C)
f 放疗会增加恶变的风险
g 原发部位的肿瘤可作为局限性疾病来治疗
h 见放疗原则(BONE-D)
GCTB-2
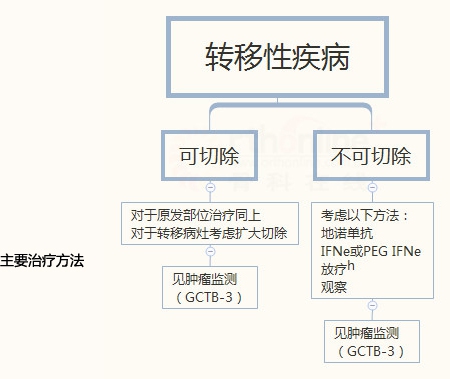
骨巨细胞瘤
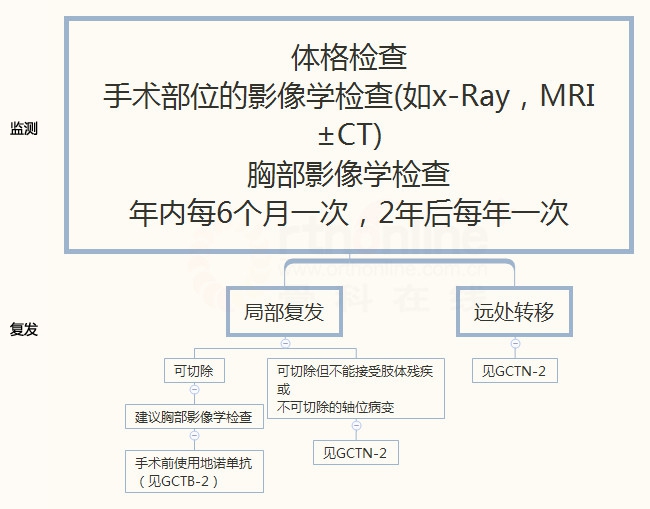
GCTB-3
骨肉瘤
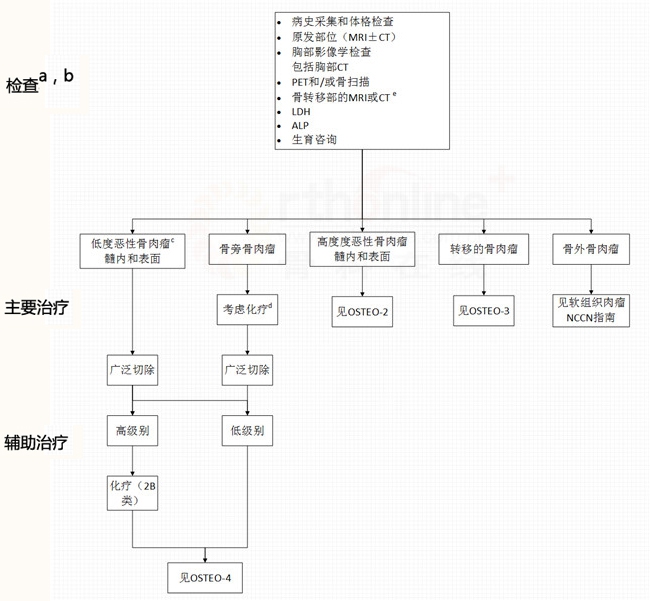
a 见多学科团队(BONE-A)
b 见骨肿瘤治疗原则(BONE-B)
c 去分化骨旁骨肉瘤不被认为是低度恶性肿瘤
d 见骨肿瘤全身治疗药物(BONE-C)
e 初级影像学检查发现的可疑转移性病灶,需要更加详细的影像学检查来确定(CT or MRI)
h 见放疗原则(BONE-D)
i 其他高度恶性非骨肉瘤的变型可以使用该指南推荐,比如骨的未分化多形性肉瘤(UPS)
OSTEO-1
骨肉瘤

b 见骨肿瘤治疗原则(BONE-B)
d 见骨肿瘤全身治疗药物(BONE-C)
f 选择老年患者可能受益于立即手术
g 肿瘤化疗反应是通过病理检查确定,反应好表示所有存活肿瘤细胞小于10%,反应差表示所有存活肿瘤细胞大于等于10%
OSTEO-2
骨肉瘤
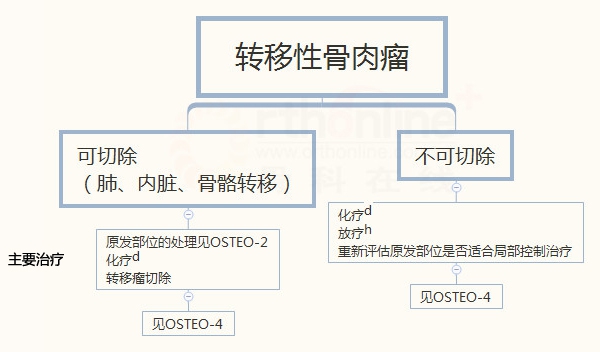
d 见骨肿瘤全身治疗药物(BONE-C)
h 见放疗原则(BONE-D)
OSTEO-3
骨肉瘤

d 见骨肿瘤全身治疗药物(BONE-C)
j 使用和初次检查相同的检查来评估病情
TSEO-4
多学科团队

BONE-A
骨肿瘤的治疗原则

BONE-B

BONE-C
概述
原发性骨肿瘤是极为罕见的肿瘤,占所有肿瘤的不到0.2%,尽管这些罕见肿瘤的真正发生率难以评估。据估计,2014年美国共确诊新病例3020例,其中1460例死于该疾病。原发性骨肿瘤临床表现多种多样,经过合适的治疗通常是可以治愈的。骨肉瘤(35%)、软骨肉瘤(30%)、尤文氏肉瘤(16%)是最常见的三种骨肿瘤。高度未分化多形性骨肉瘤、纤维肉瘤、脊索瘤、骨巨细胞瘤是相对罕见的肿瘤,占所有原发恶性骨肿瘤的1%至5%。骨巨细胞瘤有良性及恶性两种类型,而良性最为常见。
各类型的骨肿瘤根据其组织学来源命名:软骨肉瘤来源于软骨、骨肉瘤来源于骨、骨纤维肉瘤来源于纤维化组织,而血管内皮瘤及血管外皮瘤来源于血管组织。脊索瘤来源于脊索组织。部分原发骨肿瘤包括尤文氏肉瘤的组织来源尚不明确。脊索瘤多见于男性,发病高峰在50至60岁。
大部分骨肿瘤的病因和发病机制仍不明确。尤文氏肉瘤的发病机制表明是EWS和ETS之间的基因重排,而骨肉瘤的发病机制则为种系变异。Li-弗劳梅尼综合征是由于P53基因的种系突变所致,有高度的风险进展为骨肉瘤。骨肉瘤是在由于视网膜母细胞RB1基因突变所致的视网膜母细胞瘤患者中第二常见的原发恶性肿瘤。由于DNA解螺旋酶的突变所致的其他的遗传基因综合征,骨肉瘤的发病率也随之升高。骨肉瘤也是最常见的由放射诱导产生的肉瘤。
多药新辅助化疗及辅助化疗的发展已经改善了骨肉瘤及尤文氏肉瘤患者的预后。经过多学科治疗,大约四分之三的骨肉瘤患者可被治愈,90%-95%的骨肉瘤患者可通过保肢的方法成功治愈,而不必截肢。尤文氏肉瘤患者的生存率已经上升至将近70%。在诊断时已经转移的骨肉瘤及尤文氏肉瘤患者,治愈仍然是可以实现的。
NCCN骨肿瘤指南重点关注脊索瘤、软骨肉瘤、尤文氏肉瘤、骨巨细胞瘤及骨肉瘤。
文献检索标准及指南更新方法
在NCCN骨肿瘤指南版本更新以前,以软骨肉瘤或脊索瘤或尤文氏肉瘤或骨巨细胞瘤或骨肉瘤为检索词在PUBMED数据库中搜索2013-01-01至2014-07-17的骨肿瘤文献。选择PUBMED数据库是因为它仍然具广泛使用的医学文献和索引。
搜索结果缩小至英文文献,检索结果限于以下几种文章类型:II期临床试验,III期临床试验,IV期临床试验,指南,随机对照试验,Meta分析,系统回顾和交叉效度研究。
检验PUBMED检索的118篇引文及它们的潜在相关性,来源于PUBMED核心和附加的文章数据是被视为与指南相关,并被包含进讨论部分进行讨论(例如正式出版前的电子出版,会议文摘)。在缺乏高水平证据的情况下推荐是基于低水平证据和专家意见。
NCCN指南的全部更新细节在www.NCCN.org可获得。
分期
2010年AJCC分期是基于组织学分级(G)、肿瘤大小(T)、累计区域(N)和/或远处转移(M)。手术分期系统是骨与软组织肉瘤分期的另一种方法,有骨与软组织肿瘤协会制定(见表二)。这个系统根据外科分级(G)、局部浸润(T)和是否存在区域性或远处转移对骨与软组织病变进行分级。它可作为AJCC分期系统的补充。
骨肿瘤的治疗原则
多学科队伍协作
治疗原发骨肿瘤和部分转移性肿瘤,应当依靠专业的多学科小组对肿瘤进行评价和治疗。由于存在复发及化疗和放射治疗相关并发症的危险,长期监控和随访是必要的。长期生存患者还需扩展治疗及监控,以避免手术、放疗、化疗的潜在副作用。为了解患者生存状态,应安排一个多学科小组进行随访。部分患者应该与之讨论生育方面的问题。
关于青少年与年轻成人的疾病相关与生存状态相关的信息,请检索适用于青少年及年轻成人肿瘤的NCCN指南。
诊断步骤
患者有疼痛病灶,平片上病灶边缘欠佳,应怀疑恶性骨肿瘤。40岁以下的患者出现进行性疼痛骨病变,恶性原发性骨肿瘤的可能性很大,应转到骨肿瘤科进行进一步的诊断。40岁以上患者,如果依靠病史和平片无法得出一个明确诊断,应进行胸部、腹部和盆腔CT、骨扫描、乳腺X片和其他影像学检查。
所有怀疑为骨肉瘤的患者应进行分期后取活检。对可疑原发性骨肉瘤分期的标准步骤应包括胸部影像学(胸片或胸部CT检测肺转移),原发病灶的影像学检查(平片、局部分期的MRI或CT扫描)和骨扫描。全身MRI检查对小细胞肿瘤、尤文氏肉瘤、骨肉瘤的骨转移是敏感的。对于无痛病变,在进行骨科影像学检查后,如有必要,应转由适当的多学科团队进行诊治。实验室检查如CBC、乳酸脱氢酶(LDL)、碱性磷酸酶(ALP)应该在开始治疗以前完成。
PET或PET/CT是另一种成像技术,已用于骨和软组织肉瘤治疗前的分期。近期有研究报告利用PET扫描评估骨肉瘤、尤文氏肉瘤家族肿瘤、进展期脊索瘤对化疗的反应。在放疗以前PET或PET/CT利用放射性物质F在残余的脊索瘤中显示出了缺氧组织。此方法正在临床试验,它将会有助于通过低氧水平来识别肿瘤对放疗的抵抗性。
活检
开放性活检和经皮活检(针芯活检或细针穿刺)是用于诊断肌肉和骨骼疾病的两种方法。由于标本量大,开放性活检是最准确的方法,可用于行免疫组化及细胞学。但是开放性活检需要全麻或者局麻以及手术室,而针芯活检只需局部麻醉,需或不需进入睡眠状态。当取得合适的标本时,针芯活检可作为另外一种方法诊断肌肉骨骼疾病,其准确率在88%至96%。部分需减少费用的患者可使用针芯活检。最近影像技术的进展有助于影像指导下行经皮活检诊断原发性和继发性骨肿瘤。由于缺乏开放性活检及针芯活检的随机对照试验,活检方法的选择仍有争议。
指南推荐在进行任何外科处理原发灶之前应行针芯活检或开放性活检明确原发性骨肿瘤诊断。为提供精确的治疗,在怀疑原发性恶性骨肿瘤的患者应在中心行活检。在活检时应妥善固定患骨,采取适当的措施防止病理性骨折发生。活检的位置对保肢手术非常重要,活检位置不当可能导致患者预后不良。在一项纳入了597例肌肉骨骼肿瘤患者的多中心研究中,19%的患者有治疗计划(复杂的切除或辅助治疗)变更,18例患者遭遇了不必要的截肢。
如果肿瘤切除过程中未整体移除,开放性活检或针芯活检均有肿瘤复发风险,经过活检通道肿瘤溢出或播散。针芯活检肿瘤播散风险较低。无论如何,针芯活检及开放性活检适用相同的原则。在制定活检计划时,外科医生、肌肉骨骼肿瘤学家、骨病理学家的联系是重要的。为了保证原发肿瘤切除术中切除同样宽的范围,外科医生合作选择活检路线使其位于计划切除范围内是必要的。由于细针穿刺诊断准确性低于针芯活检,其不适于诊断原发病灶,尽管在细针穿刺活检中肿瘤播散并不重要。
手术
外科手术边缘应该达到阴性,切除范围应当最大限度减少局部复发的风险,并且最大限度减少对功能的影响。广泛切除意味着手术边缘为组织学阴性,以达到最佳的局部控制效果。局部肿瘤治疗可通过保肢手术或截肢实现。对部分患者而言,截肢可能是达到这一目标的最佳选择。然而,能够合理保全功能时,应首选保肢手术。最终病理的评估应当包括手术边缘及肿瘤大小的评估。利用病理分析可对术前化疗的反应进行评估。建议患者咨询物理治疗师,进行术后的恢复训练,并制定合理的功能重建治疗方案。
放射治疗
放射治疗既可以作为可切除肿瘤患者手术治疗的辅助治疗,也可作为肿瘤无法外科切除患者的最终治疗。应用专业的技术例如调强适形放射治疗、粒子束流放射治疗(质子、碳离子、其他重离子)、立体定向放射外科、分次立体定向放射治疗以在最大限度保护正常组织的情况下传递更高的放射剂量。放射治疗应在同样专业的中心进行管理,提供外科的和系统的治疗。具体每个亚型的治疗面积和放疗剂量请参看指南中的放射治疗原则。
软骨肉瘤
软骨肉瘤的特点是从缺乏类骨质的肿瘤组织中产生软骨基质,该病可发生在任何年龄阶段,在老年人中常见,好发于骨盆和股骨近端。其中发生于骨的软骨肉瘤占85%,分类如下:(1)原发性或中央病灶,发生于此前外观正常的软骨;(2)继发或周围性肿瘤,由之前存在的良性软骨病变发展而来,如软骨瘤或由骨软骨瘤的软骨部分发展而来。有报道Oilier病(内生软骨瘤病)患者和Maffucci综合症(与软组织相关的内生软骨瘤病)可出现恶变。外周性或继发性肿瘤通常为低度恶性,很少转移。大约一半的软骨肉瘤和几乎所有的Oilier病和Maffucci综合症患者与异柠檬酸脱氢酶突变(IDH1或IDH2)有关。
除上述各类型以外,还有10%到15% 其他亚型,包括透明细胞型,去分化型,黏液型和间质型软骨肉瘤。原发性黏液样软骨肉瘤是一类罕见的肿瘤,其独特临床病理特征尚未被完全阐明,为一种黏液样变性的中度或高度恶性的软骨肉瘤,好发于髋关节骨周围。研究显示视网膜母细胞瘤的变异途径也表现于绝大多数透明细胞型,去分化型和间质型软骨肉瘤中。
另一方面,骨外黏液样软骨肉瘤是一种罕见的软组织肉瘤,其特征为染色体t(9;22)(q22;q11-12)或t(9;17)(q22;q11)平衡易位,分别生成融合基因EWS-CHN (EWSR1-NR4A3)或RBP56-CHN (TAF2N-NR4A3)。此外,有个案报道显示骨外黏液样软骨肉瘤的另两个突变的染色体t(9;15)(q22;q21)和t(3;9)(q12;q22)可易位,分别生成融合基因TCF12-NR4A3和TFG-NR4A3。最新一项回顾性研究显示骨外黏液样软骨肉瘤患者生存期延长,尽管其属于易局部或远处复发的肿瘤。且肿瘤体积越大,无病生存率越低。骨外黏液样软骨肉瘤不包含在NCCN骨肿瘤指南中。
软骨肉瘤的症状取决于肿瘤的大小和位置,通常较轻微。盆腔或躯干病变通常在病程后期才有表现,其相关疼痛的发作较隐匿,肿瘤往往已较大时才发生。中央型软骨肉瘤在X线片上表现为皮质破坏和髓质骨小梁丢失,以及钙化和骨破坏。
磁共振可显示肿瘤的髓内浸润以及骨外侵袭范围。继发病变由先前存在的病变引起。系列X线片可显示骨软骨瘤或内生软骨瘤有缓慢增大。骨骼成熟后,在已存在的病变处或已记录的大小处出现大于2cm的软骨“帽”时,应怀疑病变向肉瘤转化。
预后因素
病灶的原发型或继发型、中央型或外周型、解剖位置、以及其大小都是影响软骨肉瘤预后的因素。从SEER数据库中分析了2890位软骨肉瘤的患者,单因素分析结果显示女性、组织病理低度恶性、局部手术阶段与疾病生存获益有关,而多因素分析显示只与分级、分期有关。
治疗
手术
针对巨大肿瘤和骨盆处肿瘤的患者,不管分级,首选阴性外科切缘的广泛切除治疗。充分外科切缘的切除术能提高躯干和骨盆处软骨肉瘤患者的无病生存期和总生存率,10年的无病生存率和总生存率分别是61%、44%,而不充分外科切缘的切除术患者的10年无病生存率和总生存率分别是17%、0%。低级别(I级)、局限性的软骨肉瘤患者通过冷冻手术达到的囊内切除不易复发。对于有选择的低度恶性、影像学显示几乎无浸润、非盆腔软骨肉瘤的患者,囊内切除可作为广泛切除的替代治疗。
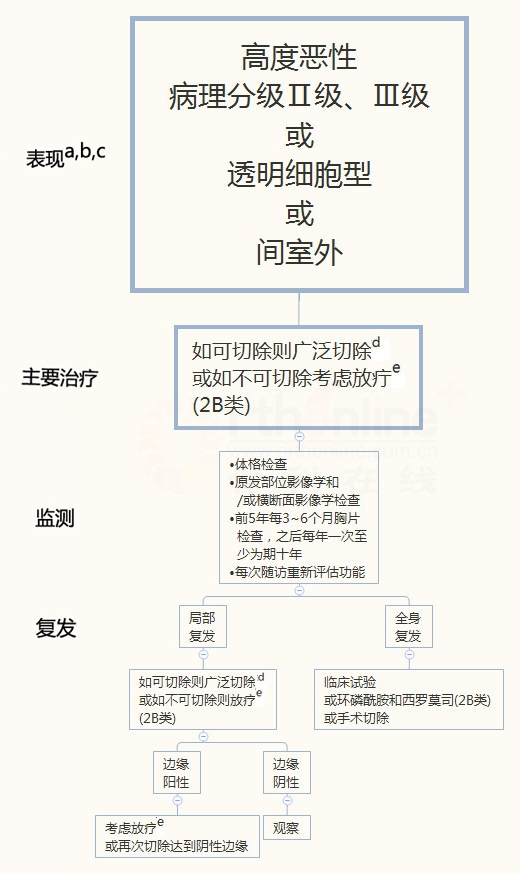
组织学分级和肿瘤位置是决定治疗方案的最重要的因素。低度恶性的可切除肿瘤和问室内病变可通过病灶内切除,可添加辅助化疗,或通过阴性外科切缘的广泛切除治疗。高度恶性(II、III级或透明细胞型)或间室外病变,如可切除,应采用广泛切除治疗,并达到外科边缘肿瘤阴性。
放疗
针对手术切除不完全肿瘤患者,或为缓解进展期不可切除的肿瘤的症状,可考虑选择放疗。一项回顾性研究分析了60名颅外高风险软骨肉瘤的手术后患者,发现放疗作为手术的辅助方法(手术前或手术后),可以使不适合广泛切除的肿瘤得到很好持久地局部控制。最近一项回顾性研究发现,间质型软骨肉瘤患者辅助放疗控制局部肿瘤可以减少复发率。低度恶性的颅底或颈椎软骨肉瘤患者接受质子放疗可取得良好的局部控制效果和长期生存率。两项研究显示接受质子放疗的颅底软骨肉瘤患者局部控制率分别是92%、94%。
Noeletal等人对26名接受联合治疗方案(手术切除联合质子放疗)的颅底或颈椎软骨肉瘤患者进行了随访,发现3年局部控制率可达到92%。另一项研究发现,接受手术联合质子放疗治疗的299名颅底软骨肉瘤患者10年局部控制率可达到94%。颅底软骨肉瘤患者接受重离子放疗同样可以带来良好的局部控制效果。
化疗
化疗对软骨肉瘤不是很有效,特别是常规软骨肉瘤和去分化软骨肉瘤。Mitchell等人报告,顺铂、阿霉素的辅助化疗可提高去分化软骨肉瘤患者的生存率。但是,这一结果未能被其他研究所证实。Cesari等人报道,辅助化疗可提高问质型软骨肉瘤患者的生存率。另一来自德国的研究小组也证实间质性软骨肉瘤的年轻患者接受化疗的效果更好。由于目前尚缺乏前瞻性随机对照试验的证据,化疗的治疗效果尚未被认可。
NCCN推荐意见
肿瘤的病理分级和生长位置是决定治疗方案的最重要因素。
低度恶性的可切除肿瘤和室间内病变首选广泛切除或囊内切除,可辅助其他治疗。骨盆低度恶性的软骨肉瘤优先选择广泛切除。高度恶性(II、III级)或透明细胞型或间室外病变,如可切除 ,应采用广泛切除治疗并达到外科阴性切缘。广泛切除可能通过保肢或截肢达到阴性外科切缘。
术后给予质子放疗对于那些由于肿瘤的生长位置而不能切除的患者可能是有利的,特别是颅底、颈椎软骨肉瘤的患者。对于那些低度恶性或高度恶性的不可切除的肿瘤患者,可考虑进行放疗。然而,即使目前没有足够的数据支持放疗对软骨肉瘤的作用,上述方案仍为2B类推荐级别。
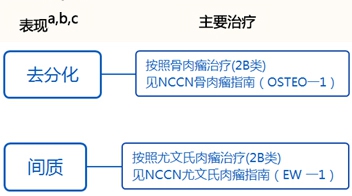
传统的软骨肉瘤(1-3级)目前没有确定的化疗方案。指南建议去分化软骨肉瘤可参照骨肉瘤的治疗方案,间质软骨肉瘤治疗可参考尤文氏肉瘤的治疗方案,根据分化等级选择最合适的治疗。上述两个方案均有2B类建议。
监测
低度恶性病变的监测包括体格检查、病灶和胸部影像学检查,前2年每6-12个月进行1次,以后每年一次。
对于高度恶性病变的监测包括体检、原发病灶的影像学检查和/或横截面成像,以及胸片,前5年间每3-6个月检查1次,后每年1次,为期至少10年,因为软骨肉瘤的迟发转移和复发易在5年后发生。每次随访期间,应对患者的功能进行重新评估。
复发
局部复发时,病灶可以切除的条件下,应该采用广泛切除。广泛切除后,如果为阳性外科切缘,需考虑进行放疗或再次切除以达到阴性手术切缘。手术切除应该达到阴性手术切缘。不能手术切除的病变可考虑放疗。高度恶性病灶全身复发时,可选择手术切除或鼓励患者参加临床试验。近期一项回顾性研究显示,10名不能切除复发的软骨肉瘤患者给予西罗莫司联合环磷酰胺治疗方案,疾病控制率达70%(10%的患者达到预期效果,60%患者病情稳定)。全身复发的高度恶性软骨肉瘤给予西罗莫司联合环磷酰胺治疗方案的推荐级别为2B类。
脊索瘤
脊索瘤起源于脊索的胚胎残留,常见于老年人,好发于中轴骨,其中骶骨(50%–60%)、颅底(25%–35%)和脊柱(15%)为最常见的发病位置。脊索瘤根据组织学可分为三种类型:经典型、软骨型和去分化型。其中经典型最为常见,其特点为缺乏软骨和间质成分。软骨型脊索瘤占5%-15%,其具有了脊索瘤和软骨的组织学特征。去分化型脊索瘤占2%-8%,其具有了高度恶性多形性梭形细胞软组织肉瘤的特征,且易浸润。
脊柱和骶骨脊索瘤临床多表现为局部剧痛或神经根痛,而颈部脊索瘤易引起呼吸道的阻塞或吞咽困难,表现为口咽部肿块。较骶尾部脊索瘤,颅底和脊柱节段脊索瘤更易引起神经功能缺损。
检查
初始的检查包括病史采集、体格检查、发病部位充分的影像学检查(X片、CT和MRI)、脊髓轴的MRI扫描和胸部、腹部和盆腔CT。特殊情况下可进行PET扫描或骨扫描(PET扫描为阴性情况下)。良性脊索细胞肿瘤(BNCTs)考虑为脊索瘤的癌前病变,不需要进行手术治疗。CT和MRI检查可以区分BNCTs和脊索瘤。
对于颅底脊索瘤,CT可以看见骨质的破坏和钙化灶。大脑边缘处的肿瘤,为了解肿瘤的位置和侵犯周围的软组织及血管情况,首选MRI检查。对于骶尾部脊索瘤,CT和MRI有助于评估软组织改变、钙化和硬膜外浸润情况。RMI了解周围软组织对比情况比CT更精确且更具优势,有助于评估复发和远处转移。CT对于评估脊柱脊索瘤骨的形态、钙化和软组织、硬膜外浸润显得十分重要,然而为了解肿瘤的扩展、脊髓压迫、局部复发和术后瘢痕组织中残余癌,MRI是最佳的影像学检查方法1。邻近骶骨处肿瘤患者受力骨缺失,CT扫描对于骨重建具有十分重要的作用。
影像学检查后应该做活检确定肿瘤的组织学类型,主要取决于肿瘤解剖位置。颅底肿瘤不推荐穿刺活检。怀疑骶骨脊索瘤的患者,应该行经背部活检术而不是经直肠穿刺。
治疗
手术
充分手术切缘的广泛切除是脊索瘤首选的治疗方案。近期对SEER数据库中962名脊索瘤患者进行回顾性研究分析,结果显示手术能提高总体生存率。其他几项研究分析了骶骨、颅底、脊柱脊索瘤患者的无病生存率和总体生存率,结果显示广泛性切除对于提高预后十分重要。
Boriani等对脊柱脊索瘤患者进行了为期5年多的随访,发现只有达到阴性外科切缘的切除术与患者的连续无病生存密切相关。18位患者中12位患者接受了整块切除,无病生存期平均达到8年,而其余接受囊内切除的患者2年内出现复发。Ruggieri等对骶骨和脊柱脊索瘤患者进行了随访,发现广泛切除达到阴性外科切缘的患者复发率仅为17%,而囊内切除的患者复发率达81%。Tzortzidis等报道侵入性显微外科切除颅底脊索瘤治疗方案与患者的长期无瘤生存和良好的功能保留密切相关,其中能完全切除的患者占72%,局部控制达50%。一项研究对802名颅底脊索瘤患者进行meta分析,结果显示不完全切除的患者5年复发率是完全切除的3.83倍。
放疗
放疗(术前、术中、术后)用于可切除的骶骨和颅骨脊索瘤患者的手术辅助治疗方法,可以提高其局部控制率和无病生存率。对24名骶骨和颅骨脊索瘤患者进行回顾性分析,发现术前短期放疗、手术切除和术后高剂量联合治疗方案可以使患者的5年无病生存率和局部控制率分别达到54%、72%。近期的一项针对15名骶骨脊索瘤术后患者的研究显示,囊内切除联合放疗患者(20%)局部复发率比仅广泛切除患者(2年复发率达100%)低,且复发的时间延长。传统型或软骨型颅底脊索瘤,手术联合放疗可以改善局部复发率。
特殊的放疗手段IMRT,、SRS和FSRT,可以提高颅骨和颅外脊索瘤患者的局部控制率。
全身治疗
脊索瘤对化疗不敏感,除了去分化型脊索瘤的去分化部分。几个信号传导通路,如血小板源生长因子受体、表皮生长因子受体(EGFR)和雷帕霉素靶点(mTOR))与脊索瘤的发病机制密切相关,从而推进了靶向治疗。Ⅱ期临床实验,56名进展期脊索瘤患者接受伊马替尼治疗(酪氨酸激酶抑制剂),70%的患者病情稳定。根据RECIST标准,临床获益为64%(完全有效,部分有效且病情稳定达6个月以上),且平均无进展生存期在有意愿治疗患者中达9个月。伊马替尼联合顺铂或西罗莫司对于伊马替尼耐药的患者有一部分人有效。
表皮生长因子受体抑制剂的作用在在伊马替尼耐药的进展期脊索瘤患者中得到证实,如埃罗替尼及拉帕替尼。对18名局部进展期和转移的患者进行Ⅱ期临床实验,拉帕替尼诱导反应达33%(根据Choi标准),病情平稳达39%(根据RECIST标准)。根据Choi标准和RECIST标准,平均无进展生存期分别为6个月和8个月。
NCCN推荐意见
对于传统型和软骨型脊索瘤,肿瘤的生长位置是决定治疗方案的最重要因素。去分化型脊索瘤治疗参照NCCN软组织肉瘤指南。广泛切术联合或不联合放疗是可切除传统型和软骨型骶骨和脊柱脊索瘤的首选治疗方法。而对于可切除传统型和软骨型颅底脊索瘤的患者选择囊内切除联合或不联合放疗(MRI随访评估切除是否充分)。适当时,进行扩大安全切除是推荐的。巨大的侵犯型肿瘤或阳性外科切缘的患者可考虑辅助放疗。术后放疗可以提高局部控制率和延长无病生存期。对于阳性手术切缘的颅底脊索瘤患者,可考虑再次手术治疗。对于不可手术切除的脊索瘤患者,无论肿瘤生长的位置,首选放疗。
监测
监测包括体检、手术部位根据临床选择影像学检查(X片,MRI±CT)、胸片(前5年间每6个月检查1次,后每年1次),以及腹部平扫(每年)。
复发
脊索瘤具有局部高复发率,且局部复发的患者远处转移率达40%。Fagundes等报道,在颅底和脊柱脊索瘤复发患者中,接受部分切除2年生存率比姑息性治疗高(分别为63%、21%;P=.001)。然而,也有研究显示在骶骨脊索瘤患者中,手术和放疗治疗复发患者局部控制率较原发性患者低。
复发的患者可以接受手术治疗和/或放疗和/或全身治疗。EGFR阳性的肿瘤复发患者的全身治疗指南包括了伊马替尼联合或不联合顺铂或西罗莫司、埃罗替尼、舒尼替和拉帕替尼。
尤文氏肉瘤家族肿瘤
ESFTs是一组小圆细胞肿瘤,包括尤文氏肉瘤、原始神经外胚层肿瘤(PNET)、阿斯金肿瘤、骨的PNET、骨外尤文氏肉瘤。尤文氏肉瘤的特征是位于22号染色体q12的EWS基因(EWSR1)与ETS基因家族的不同成员(FLI1,ERG、ETV1 ETV4,FEV)之间的融合。85%的尤文氏肉瘤患者中发现11号染色体上EWS与FLI1融合并发生对应位置的易位t(11;22)(q24;q12),最终形成EWS-FLI1。在5%至10%的情况下,EWS与ETS基因家族的成员融合,在罕见情况下FUS替换EWS导致融合后没有EWS基因,重组排列形成FUS-ERG融合基因,形成染色体易位t(16;21)(p11;q24) 或者FUS-FEV易位t(2;16)(q35;p11)。尤文肉瘤的特点是细胞表面的糖蛋白MIC2(CD99)高表达。MIC2的表达可能对Ewing氏肉瘤和PNET其他小圆细胞肿瘤的鉴别诊断是有用的,但MIC2在这些肿瘤中是非唯一非特异的。
通常,ESFT发生在青少年。最常见的发病部位是骨盆的骨、股骨和胸壁的骨,其他任何骨也可能发病。长骨骨干是最常见的发病部位。在成像上,骨头出现斑点。骨膜反应是典型的影像学表现,由放射科医生称为“洋葱皮”现象。尤文氏肉瘤患者和多数骨肿瘤患者一样因为局部疼痛和肿胀就诊,但不像其他骨肿瘤患者,它的基本症状包括发热、白细胞降低和突然明显疲劳,可能出现的异常实验室检查包括血清乳酸脱氢酶升高和白细胞增多。
预后良好的重要指标包括原发灶位于四肢、肿瘤体积<100ml、乳酸脱氢酶正常、未发现转移性病灶。脊柱和骶骨尤文氏肉瘤患者比其他部位的患者有更差的预后和结果。
同其他骨肿瘤一样,转移也是尤文氏肉瘤最重要的不良预后因素。肺、骨、骨髓是最常见的转移部位。EICESS研究小组回顾性分析了975例患者,其中转移患者5年无复发生存率仅22%,未转移患者为55%。在所有转移患者中,肺转移患者相对于骨转移或肺合并骨转移患者有更高的生存率。对局限性无转移的尤文氏肉瘤患者,肿瘤对化疗的低反应同样被认为是不良预后因素。
IESS研究分析了303例尤文氏肉瘤的临床病理特点,结果表明,原发于骨盆的患者相较原发于四肢远端的患者有更低的生存率。一项关于53例(24位成人和29位儿童)尤文氏肉瘤患者接受化疗的多变量分析中,Gupta等认为,骨盆病灶和局部治疗的时间是无进展生存率重要的预后因素。在另一个尤文氏肉瘤患者的回顾性分析中(样本来源于大型基础癌症登记处),Lee等人认为年龄、拉美裔人种、转移、肿瘤过大、和低社会经济地位是总生存率的不良预后因素。
检查
如果怀疑诊断为ESFT,患者必需在活检前进行肿瘤分期。应包括胸部CT,原发部位的MRI±CT,PET扫描和/或骨扫描,骨髓活检或脊柱骨盆MRI。一个系统回顾性荟萃分析中,Treglia等人认为,PET or PET/CT结合传统影像检查对ESFT患者分期及重新分期是有价值的方法(96%敏感性,92%特异性)(179)。一项正在进行中的诊断性研究中,比较了全身MRI与传统影像学检查来评价远处转移的诊断效果,其中病种包括儿童ESFT,霍奇金淋巴瘤,非霍奇金淋巴瘤,横纹肌肉瘤,神经母细胞瘤。
活检标本的细胞遗传学研究和/或分子研究应该考虑用来评价t(11;22)易位。初步研究表明,EWS-FLI1易位比其他变异型有更好的预后。然而,EURO-EWING99和儿童肿瘤协会的研究表明,通过目前有效的疗法,无论何种融合亚型的尤文氏肉瘤患者有类似的结果。
除了EWS,经过分子诊断的FUS应当被考虑为融合基因的一员,来识别FUS-ERG或FUS-FEV融合转录形成的罕见尤文氏家肉瘤族肿瘤病例。为完善诊断,应进行骨髓活检。血清LDH是一种已被证明具有判断预后价值的肿瘤标志物NCCN骨肿瘤指南将该检验列为尤文氏肉瘤患者的初步评估手段。生育咨询应当被考虑。
治疗
局部控制治疗
手术和放疗作为一种局部控制的治疗方法用于局限性肿瘤患者。没有随机研究比较这两种治疗方法。
尤文氏肉瘤患者的局部治疗组间合作研究显示,局部控制(手术、放疗、或手术加上放疗)没有显著影响OS及EFS。在CESS86研究中,虽然根治性切除和切除联合放疗导致更好的局部控制率(分别为100%和95%),放疗只有86%。但是由于更高的术后转移率,并没有改善RFS或OS。在INT-0091研究中,单纯手术或单纯放疗有相近的局部复发率(25%),而手术联合放疗局部复发率只有(10.5%)。在手术组、放疗组、手术联合放疗组中5年EFS(42%,52%,47%)没有显著的统计学差异。
其他回顾性研究表明,在局限性疾病的患者中手术(术后放疗或不加放疗)比单纯放疗有更好的局部控制率。联合研究(CESS 81,CESS 86,EICESS 92),包含1058位患者,表明手术(术后放疗或不加放疗)比放疗有更好的局部控制率(7.5%vs.26.3%;P=.001),而术前放疗组与手术组局部控制率相当(5.3%)。儿童肿瘤协会最近的回顾性序列研究(INT-0091,INT-0154,AEWS0031)表明手术联合放疗比放疗有更低的局部复发率,但两者对远处转移率没有影响。对于因肿瘤解剖位置而无法达到手术广泛切除边缘的患者,局部放疗可能是一种有效的治疗选择。
有研究表明,脊柱与其它部位的尤文氏肉瘤经过局部放疗后的局部复发率相当,而脊柱尤文氏肉瘤的5年EFS和OS分别是47%和58%。经过化疗和局部放疗的非转移性尤文氏肉瘤患者,可以用肿瘤大小和放疗剂量来预测局部控制率。对初次转移的患者,局部控制治疗也可以改善预后。有研究表明,不接受局部控制治疗的初次转移患者相比接受局部控制治疗的人的3年EFS显著降低。
化疗
在美国和欧洲,很多单一以及协作试验证明,尤文氏肉瘤患者的可替换主体化疗方案包含异环磷酰胺和/或环磷酰胺、依托泊苷、阿霉素和/或放线菌素d、长春新碱是有效的。术前新辅助治疗可以降低肿瘤分期,同时增加完整手术切除并达到显微镜下阴性切缘的机率。术后辅助化疗可以改善大部分患者的RFS和OS。有研究表明,对于局限非转移性患者,放疗联合辅助化疗方案VACD(长春新碱、放线菌素D、环磷酰胺、阿霉素)优于联合化疗方案VAC(长春新碱、放线菌素D和环磷酰胺)。VACD和VAC联合方案的5年RFS分别为60%和24%,(P<.001)。相应的OS为65%和28%(P<.001)。
单独将异环磷酰胺或者联合依托泊苷加入标准化疗方案,一直被评估在新诊断的非转移性尤文氏肉瘤患者中的疗效。儿童肿瘤组和儿科癌症研究组的最新研究(INT-0091),398例非转移性ESFT被随机分配接受VACD方案化疗组或联合异环磷酰胺和依托泊苷组成(VACD-IE)方案化疗组,共行17个周期化疗。VACD-IE组的5年EFS显著高于VACD组(69%与54%;P=.005)。VACD-IE组的5年OS显著高于VACD组(72%与61%;P=.01)。在不考虑局部控制治疗的类型的情况下,VACD-IE组的局部复发率(11%)低于VACD组(30%)。
在VAC-IE化疗方案中,提高烷基化剂的剂量并不能改善局限性疾病患者的临床结局。通过间隔增强化疗强度的方法可以改善局限性患者的临床结局。在一个关于小于50岁局限性尤文氏肉瘤患者的随机试验中(n=568),Womer等人认为,VAC-IE方案每2周给予1次比每3周1次有效,并没有药物毒性的增加,平均5年EFS是73%和65%。
而对于转移性尤文氏肉瘤患者,在所有的研究中,添加异环磷酰胺和/或依托泊苷入标准化疗方案,没有改善临床结果。有研究(INT-0091),该研究包括120例转移性患者,选择VACD-IE或者VACD方案在OS和EFS没有显著差异。两组的5年EFS均为22%,VACD-IE组5年OS为34%,而VACD组为35%。在一项68位患者的研究中(44位局限性病变,24位转移性病变),Kolb等人报道4年EFS和OS为82%和89%。局限性病变患者接受密集化疗(阿霉素、长春新碱±大剂量环磷酰胺),然后是异环磷酰胺和依托泊苷。远处转移患者相应的存活率分别为12%和18%,Miser等人报道,在诊断为转移性尤文氏肉瘤或转移性骨的PNET患者中也有相似的结论。
EICESS-92研究,调查在低风险的尤文氏肉瘤患者中(小的局限性肿瘤)环磷酰胺是否有类似于异环磷酰胺的功效,以及包含异环磷酰胺的依托泊苷添加方案是否有改善高危患者(诊断为巨大肿瘤或转移性肿瘤)的生存期的作用。低风险的患者被随机分配到VAIA组(异环磷酰胺、长春新碱、放线菌素D和阿霉素;n=76),然后分为VAIA或VACA(长春新碱、放线菌素D、环磷酰胺、阿霉素;n=79)。其3年EFS分别为73%和74%。最后发现,他们有相同的影响。高危患者被随机分配到VAIA或者VAIA+依托泊苷(EVAIA)。两治疗组的3年EFS没有明显不同(分别为52%和47%,EVAIA和VAIA)。然而,有一些证据表明,添加依托泊苷对无转移的患者(P=.18)比那些转移的患者(P=.84)有更大的生存受益。
作为EICESS-92研究的后续研究,Euro-EWING99-R1试验评估环磷酰胺作为替代异环磷酰胺成为整合疗法的一部分,该疗法还包括长春新碱和放线菌素D(VACvs.VAI),然后是VIDE(长春新碱、异环磷酰胺、阿霉素和依托泊苷)诱导化疗在856例低危险尤文氏肉瘤患者中。统计上VAC并不比VAI差,但事件略有增加(3年EFS下降2.8%)。病人经历严重的血液毒性事件的比例比VAI略高,但接受VAI方案的患者出现肾小管功能障碍更明显。
大剂量治疗后干细胞移植
大剂量治疗之后干细胞移植(HDT/SCT)这一方法一直在局限性或转移性患者中被评估。HDT/SCT与非转移性患者的潜在的生存受益相关。然而,有研究表明,评价HDT/SCT用于转移性患者显示相反结果。
首个大型随机试验(EURO-EWING99),旨在评估可替换主体诱导化疗的疗效和安全性,有六个关于VIDE的课程,局部治疗(手术±放疗),HDT/SCT治疗281位原发播散性尤文氏肉瘤患者。平均3.8年的随访后,发现整个研究试验组3年EFS和OS分别为27%和34%。HDT/SCT治疗后全面反应和部分反应的患者的EFS率分别为57%和25%。患者的年龄、肿瘤体积、转移扩散的程度被确定为相关的危险因素。HDT/SCT的实验没有进行,由于在非移植组早期引入偏倚(82%没有进行HDT/SCT的患者平均死于1年后)。
NCCN推荐
所有尤文氏肉瘤患者均采取以下方案治疗:初始治疗加局部控制治疗和辅助治疗。
初始治疗包括多药化疗以及适当生长因子支持12周。基于转移性疾病患者的反应可以考虑更长时间的持续治疗。VAC(长春新碱、多柔比星/IE、环磷酰胺、异环磷酰胺和依托泊苷交替)是局部疾病的病人的首选治疗方案,而VAdriaC(长春新碱、阿霉素、环磷酰胺)是转移性疾病患者的首选治疗方案。局限性和转移性患者推荐的其他化疗方案见骨癌全身治疗列表。
经过初次治疗后疾病应重新分期,方法是行病变部位的MRI及胸部影像学检查。PET扫描和/或骨扫描可用于再分期,这取决于在初始检查时使用的成像技术。初次治疗后病情稳定或好转的患者应采用局部控制治疗。局部控制治疗的选择包括广泛切除、局部放疗联合化疗、特定情况下的截肢术。局部控制疗法的选择应该实行个体化,这取决于肿瘤的位置、大小、对化疗的反应、患者的年龄、预期的复发和患者的意愿。
所有的患者,推荐广泛切除或截肢,无论手术切缘均应联合辅助化疗。专家组强烈建议,广泛切除术后化疗时间应介于28周和49周之间,这取决于方案的类型和预计的剂量(第1类)。如果手术切缘阳性或者切缘非常靠近肿瘤,建议术后放疗联合化疗(187)。Denbo等人认为患者的肿瘤体积较小(小于8厘米)、切缘阴性,术后放疗可省略,不会降低OS。评估患者15年的总生存率,接受辅助放疗为80%,没有接受放疗的为100%。对广泛切除和阴性切缘的患者建议只进行辅助化疗。
经过初次治疗的进展期疾病,最好对主要部位行放疗和/或手术,然后化疗或最好的支持治疗。
监测
ESFT患者的监测应包括体格检查,CBC和其他实验室的检查,胸部和原发部位的影像学检查每2到3个月一次。2年后监测间隔增加。长期监测应在5年后的每年进行。(类别2B)
复发或难治性疾病
大约30%到40%的ESFT患者有复发的经历(局部复发和/或远程转移),预后很差。到第一次复发,间隔时间较长的患者在复发后存活的机会更大。远期复发(2年以上从最初诊断的时间)、肺转移、局部复发,均可行根治性手术治疗,而化疗是最有利的预后因素,而早期复发(从最初诊断的时间不超过2年)在肺和/或其他部位转移、在局部和远处复发、初始诊断和初始复发时LDH升高视为不良预后因素。在最近的一项回顾性分析,在成人局部尤文氏肉瘤中,首次复发的时间和首次复发的部位是影响预后的重要因素。局部和远处复发后的5年生存率分别为50%和13%。远期复发患者复发后5年生存率也显着高于早期复发患者。
异环磷酰胺联合依托泊苷联合或不联合卡铂这一方案在临床试验中已被评估,用于治疗复发性或难治性肉瘤。在一个II期临床研究中,用美司钠和足叶乙甙联合异环磷酰胺的方案对儿童和年轻成人的复发性肉瘤治疗高度有效,且药物毒性可接受。在儿童肿瘤组进行的I期/II期研究中,复发性或难治性肉瘤患者的总缓解率为51%,1年和2年的OS分别为49%和28%。当患者的疾病完全或部分缓解时OS出现显着改善。
非基于异环磷酰胺化疗方案,也被证明在治疗复发或难治性骨的肉瘤中有作用。多西他赛联合吉西他滨方案被发现具有良好的耐受性,整体目标缓解率为29%,儿童和年轻成人难治性骨的肉瘤,中位持续反应时间为4.8个月。局部异构酶I抑制剂(拓扑替康和伊立替康)联合环磷酰胺和替莫唑胺对复发或难治性骨的肉瘤有良好的应答率。在一系列54例复发性或难治性尤文氏肉瘤,环磷酰胺和拓扑替康在44%的患者中诱导反应(35%的患者完全缓解,9%例部分缓解)。中位随访23个月后,26%的患者持续缓解。
在一个复发或进展性尤文氏肉瘤患者的回顾性分析中,伊立替康和替莫唑胺导致整体客观反应率63%。中位疾病进展时间(TTP)对所有患者(n=20)为8.3个月(232)。在2年的首次缓解且原发性局限性疾病的患者,相比那些2年内复发且转移的患者有更好的TTP。在治疗复发或难治性尤文氏肉瘤时,联合治疗包括长春新碱、伊立替康、替莫唑胺的方案有积极和良好的耐受性,整体回应率为68.1%。在一项小的单中心研究中,HDT/SCT可以改善尤文氏肉瘤长期生存患者的复发或进展。这种方法的作用尚未在前瞻性随机研究中确定。
NCCN推荐
对复发或难治性疾病患者的治疗方案治疗包括参与临床试验、化疗加或不加放疗。如果复发延迟,仍然是这种肉瘤,先前有效的方案可能是有用的。复发或难治性疾病患者推荐的其他化疗方案见骨癌全身治疗列表。
所有复发和转移性疾病的患者应考虑临床试验作为新的治疗方法。
骨肉瘤
骨肉瘤是儿童和青少年最常见的原发恶性骨肿瘤。骨肉瘤患者的年龄中位数为20岁。65岁以上的老年人,Paget’s骨病易发展为继发性骨肉瘤。骨肉瘤大致分为3中组织类型:髓内型、表面型、骨外型。高度恶性的髓内经典骨肉瘤占全部骨肉瘤约80%,此为梭形细胞瘤,可产生类骨质或不成熟骨。该肿瘤最常见的部位是股骨远端或胫骨近端干骺端,该部位是生长最旺盛的区域。低度恶性的髓内瘤少于2%,好发部位与传统髓内骨肉瘤一致。
骨膜外和骨膜骨肉瘤累及皮质的骨旁病变。骨膜外骨肉瘤为低度恶性,占所有骨肉瘤的5%,好发于股骨远端后部,发生转移的时间晚于经典骨肉瘤。低度恶性骨膜外骨肉瘤发展为高度恶性的骨肉瘤大约24%-43%。骨膜骨肉瘤为中度恶性,最常累及股骨,其次是胫骨。高度恶性的表皮型骨肉瘤约占近皮质骨肉瘤的10%。
疼痛和肿胀是最常见的早期症状。疼痛在开始的时候往往是间歇性的,有时可延误诊治的时机,因为症状可能与生长痛相混淆。骨肉瘤经血源传播,肺是最常见的转移部位。
骨外骨肉瘤治疗参照NCCN软组织肉瘤指南。
预后
肿瘤部位和大小、是否出现转移和转移的部位、化疗的组织学反应、手术方式和手术切缘类型是肢体和躯干骨肉瘤患者重要的预后因素。对1702名肢体和躯干骨肉瘤患者进行分析,发现诊断的年龄、肿瘤大小以及转移是生存预后因素。在肢体骨肉瘤患者中,除了上述因素,诊断时肢体处肿瘤的大小和位置也是影响预后的重要因素。手术的缓解作用以及组织对化疗的反应性也是重要的预后因素。一项meta分析显示,4838名骨肉瘤患者进行新辅助化疗,女性患者化疗诱导肿瘤坏死的效果更好,生存期更长。近期一项随机对照实验显示良好术前化疗组织反应性、远端位置(不是股骨、肱骨近端)和女性可提高预后。然而,高BMI的患者比正常者生存率更低。
对于已确诊的原发性转移骨肉瘤,诊断时病灶的数量和所有病灶切除的完整性是影响预后的独立因素。有一个或很少的可切除的肺转移灶骨肉瘤患者的生存率与无转移的患者几乎一样。
对于骨肉瘤患者,血清ALP和LDH水平同样也是影响预后的因素。Bacci等对1421名患者进行分析,结果显示转移的患者血清LDH水平明显高于局部病灶患者(36.6%vs.18.8%;P<.0001)。5年无病生存率与血清LDH水平相关(39.5%患者LDH水平高,60%患者LDH正常)。同样,一项回顾性研究发现,在肢体骨肉瘤患者中ALP水平也是一个重要的影响预后因素。ALP水平高于正常4倍的患者的5年无进展率为24%,而ALP水平低于此限的患者5年无进展率为46%(P<0.001)。然而,一项多因素研究显示上述血清学水平并不是影响预后的因素,与肿瘤大小、年龄、化疗反应性相比。
检查
诊断骨肉瘤,在检查局部病灶的同时,也要留意是否有远处转移。初步筛查包括原发病灶(MRI,伴或不伴CT)、胸片、PET扫描、和/或骨扫描。对考虑有远处转移的患者,应进行清晰的影像学检查(CT或MRI)。X线片能显示皮质破坏和不规则成骨反应。病灶处的骨扫描异常有助于发现其他的共存病变。MRI提供良好的软组织对照,对于制定手术方案至关重要。MRI是研究骨内及软组织内病变范围的最佳手段,也是发现“跳跃性”转移,评估与周围结构的解剖关系的有效检查方法。此外,骨肉瘤患者的碱性磷酸酶(ALP)和乳酸脱氢酶
(LDH)通常升高。且在远处转移的患者中,血清LDH明显高于无转移的患者307。
治疗
手术
手术治疗(截肢或保肢)目前仍是主要的治疗手段。高度恶性但没有转移的骨肉瘤患者保肢和截肢对于生存率和局部复发率没有明显的差异。然而,保肢手术可以更好保留功能。对新型辅助化疗敏感的高度恶性患者,可以达到广泛切除条件下首选保肢手术。由于肿瘤的位置的原因,保肢手术不能达到充足的手术切缘的患者,应选择截肢手术。
化疗
术后辅助化疗对局限性骨肉瘤的患者有效。早期的试验性使用化疗方案包括在至少三个或更多的下列药物:阿霉素、顺铂、博来霉素、环磷酰胺或异环磷酰胺、放线菌素d和大剂量甲氨蝶呤。随后的临床试验表明短期、强化化疗方案(顺铂和阿霉素有或没有大剂量甲氨蝶呤和异环磷酰胺)可带来长期良好结果,类似多种药物化疗效果。
欧洲骨肉瘤工作组进行了一项随机对照研究,结果显示在术后没有远处转移的骨肉瘤患者中,阿奇霉素和顺铂的联合治疗比多药化疗具有更好的耐受性,且生存率没有明显的差异。其3年生存率和5年生存率分别是65%、55%。其5年无进展率为44%。在INT-0133研究中,可切除的无转移的骨肉瘤患者4种药物联合化疗(顺铂、阿霉素、甲氨蝶呤和异环磷酰胺)与3种药物联合化疗(顺铂、阿霉素、甲氨蝶呤)比较,6年无病生存率(分别为63%、64%)和总体生存率(分别为74%、70%)没有明显差异。
在局部骨肉瘤患者中,没有阿霉素或顺铂化疗方案能减小长期毒性和耳毒性。一项临床Ⅱ期研究发现,顺铂、异环磷酰胺和表柔比星联合化疗方案对于无转移的肢体骨肉瘤患者效果和耐受性较好。在为期64个月的随访中,5年无病生存率和总体生存率分别为41.9%、48.2%。在另一项多中心随机实验中发现,异环磷酰胺和依托泊苷联合方案比大剂量甲氨蝶呤和阿霉素联合方案组织反应性更高,分别为56%、39%。然而5年无病生存率和总体生存率没有明显的差异。
无论术后采用何种化疗管理方案,良好的组织反应性(坏死大于90%)可以预测生存率。881名无转移的骨肉瘤患者接受手术和新型辅助化疗,结果显示组织反应性对预后密切相关。5年无病生存率在反应良好和反应差的患者分别为67.9%、51.3%(P<.0001),总体生存率分别为78.4%、63.7%(P<.0001)。中国儿童肿瘤研究组同样得出类似的结论,在反应良好的患者中,5年无病生存率和总体生存率分别为81%、87%。在反应差的患者中分别为46%、52%。
目前已经对骨肉瘤患者增加MTP-PE的化疗方案进行了评估。对于可切除的无转移的骨肉瘤患者,增加MTP-PE的化疗可以明显提高6年总体生存率(70-78%),且无病生存率也更高。但在转移的患者中,差异不明显。MTP-PE目前尚未被FDA批准用于骨肉瘤的治疗。
局限性疾病
指南推荐,对于低恶性的(髓内和表面型)骨肉瘤和骨膜结节的患者,首选广泛切除。骨膜占位的患者可优先考虑化疗。虽然化疗已经用于骨膜型骨肉瘤治疗,但目前尚无数据证实广泛切除联合化疗可提高预后。一项研究显示新辅助化疗虽然已用于大多数患者,但并不影响预后。最近,Cesari等也报道了类似的发现,对于手术联合新辅助化疗和仅手术的患者10年总体生存率分别为86%、83%(P=.73)。对高度恶性的局限性患者进行长达25年的随访,发现新辅助化疗能显著提高无病生存率和总体生存率。
广泛切除手术后,对病理显示高度恶性的表面型、髓内型或骨膜型骨肉瘤,指南推荐辅助术后化疗(2B类)。
对于高度恶性的骨肉瘤,指南建议进行广泛切除前进行术前化疗(1类)。而对于老年患者,更适合立即手术。
对化疗反应性良好的术后患者应该继续接受几个周期的化疗。而对于低反应患者,应该考虑调整化疗方案。曾试图改善化疗敏感性差的患者的预后,但效果仍不理想。对于阳性外科切缘的患者,可考虑再次手术联合或不联合放疗。一项研究对手术切缘阳性或不明确的头颈部骨肉瘤进行了分析,结果显示手术联合放疗比仅手术患者的预后更好。
一项正在进行的随机实验,根据术前化疗组织的反应性评估了可切除的骨肉瘤患者的治疗方案。对于给予术前化疗仍不可切除的患者,推荐放疗或化疗。对于不可切除或切除不完全的骨肉瘤患者,光子联合质子放疗可以得到较好的局部控制效果。
化疗应辅助生长因子。请参照NCCN骨髓生长因子对于肿瘤治疗指南。
转移性疾病报告
诊断时已发生转移的患者大约10%-20%。转移癌患者中,诊断时转移的数量以及完整切除临床发现的所有转移灶是影响预后的重要因素。对于肺转移的骨肉瘤患者,单侧转移和转移灶数量少可以提高化疗的效果。只有2个及其以下的肺转移结节的患者2年无病生存率明显高于3个或大于3个结节的患者。
虽然化疗能提高无转移的高度恶性的局限型骨肉瘤患者的预后,但对于转移的骨肉瘤疗效却十分差。57例转移性肿瘤患者接受顺铂、阿霉素和高剂量的甲氨蝶呤和异环磷酰胺治疗,发现2年无病生存率和总体生存率分别是21%、55%。接受同样治疗方案的无转移的患者,其2年无病生存率和总体生存率分别是75%、94%。
一项研究显示通过化疗和手术转移灶可以消失的患者的长期预后比转移灶不能消失的患者更好(分别为48%、5%)。针对肺转移的骨肉瘤患者,积极化疗和切除原发病灶、转移灶可以有效提高患者预后。
对于转移灶可以切除的患者(肺、骨、内脏),指南推荐广泛切除前应辅助化疗。化疗和转移灶的切除包含在转移患者疾病管理中。对于不可切除的转移灶患者,评估原发病灶后局部控制后应行化疗和/或放疗。
监测
治疗完成后,监测应该每3月进行1次,持续2年,第3年每4个月1次,第4、5年每6个月1次,此后每年1次。检查应包括完整的查体,胸部影像、以及肢体平片。胸片异常时应进行胸部CT检查。也可考虑进行骨扫描(2B类)。每次随访时均应对功能进行重新评估。
复发或难治性疾病
大约30%的局限性骨肉瘤和80%的转移癌会复发。单发转移、第一次复发时间、第一次复发行完全切除是影响预后,提高生存率最重要的因素,不能手术的复发患者以及已经2次、3次复发的患者,预后十分差。在没有转移的骨肉瘤患者中,复发且肺内转移的时间间隔越长,则患者的预后相对于更好。2次复发手术切尽的预后价值在最近报道中得到证实。
临床试验评估了依托泊苷联合环磷酰胺或异环磷酰胺的治疗效果。一项Ⅱ期临床实验显示,在复发或难治的骨肉瘤患者中,对异环磷酰胺和依托泊苷反应率达48%。另一项Ⅱ期临床实验发现,在复发高危险的患者中,环磷酰胺和依托泊苷的反应率达19%,病情平稳者达35%。单药吉西他滨或联合方案如多烯紫杉醇和吉西他滨、环磷酰胺和拓扑替康、异环磷酰胺和卡铂和依托泊苷对复发或难治性骨肉瘤有一定的疗效。
223RaCl2 是一种亲骨性放射性药物,其对于复发性或难治性骨肉瘤的治疗尚处于早期研究阶段。美国已经批准用于前列腺癌的骨转移治疗中。
Sm-EDTMP是另一种亲骨性放射性药物,其治疗效果已经在局部复发和转移的骨肉瘤患者中和骨转移患者中进行了评估。Andersen等报道,对于局部复发的骨肉瘤和成骨性骨转移患者,Sm-EDTMP的非血液性毒性很低并且能缓解疼痛366。最近一项研究也发现Sm-EDTMP对高风险的骨肉瘤患者也有疗效。
各种分子通路的靶向抑制,如mTOR,、SRC激酶和VEGFRs,临床研究已证实其可以提高复发性或难治性骨肉瘤患者的预后。一项意大利II期临床实验发现,索拉菲尼(VEGFR抑制剂)对复发性和难治性高度恶性的且常规治疗失败的骨肉瘤患者有效。4个月内无进展生存率达46%。无进展生存期和总体生存期的中位数分别是4个月、7个月。部分控制和疾病稳定的患者分别占8%、34%。
在局部进展、转移、复发的骨肉瘤患者中已经对HDT/SCT的安全性、有效性进行了评估。在意大利骨肉瘤研究组的调查中发现,卡铂和依托泊苷治疗后给予自体干细胞解救联合手术达到完全缓解。移植相关性死亡率为3.1%。其3年总体生存率和无病生存率分别为20%、12%。此种方法对于高风险疾病的患者同样有效。
复发性或难治性骨肉瘤患者的最佳治疗方案尚未确认。如有复发,则患者需采取二线化疗,和或手术切除。根据目前的Ⅱ期临床实验结果,对于复发性骨肉瘤,指南建议索拉非尼可作为一种系统治疗的选择。参照骨癌系统性治疗药物指南中二线化疗方案的列表。期间需检测二线治疗的反应性。
对于使用二线治疗后出现进展或复发的患者,可以选择手术切除、姑息性放疗或支持治疗。
针对上述患者,指南推荐Sm-EDTMP可作为一种选择。
高度恶性未分化多形性骨的肉瘤
高度恶性未分化多形性骨的肉瘤好发于四肢骨,易发生局部复发、局部转移、远处转移。无转移的恶性纤维组织细胞瘤术后辅助化疗可以提高患者的预后。欧洲骨肉瘤组研究发现,辅助/新辅助阿霉素、顺铂化疗可提高患者的组织反应性和生存率。生存期的中位数为63个月。5年无进展生存率和总体生存率分别是56%、59%。指南推荐对于高度恶性未分化多形性骨的肉瘤的管理应该参照骨肉瘤。
总结
原发性骨肿瘤是非常罕见的恶性肿瘤。骨肉瘤,软骨肉瘤和尤文氏肉瘤是3种最常见形式的原发性骨肿瘤。高级别UPS,脊索瘤,骨巨细胞瘤非常罕见。
软骨肉瘤通常发生于中年和老年人。广泛切除是可切除低度和高度恶性软骨肉瘤的首选治疗。
加或不加辅助治疗的囊内切除是影像学评价无进展、非盆腔、低度软骨肉瘤低度恶性病变的另一种治疗方案。质子和/或光子束放疗可用于病灶位于的颅底或位置不适合手术切除的中轴骨软骨肉瘤。除了间叶细胞型和去分化型,放疗对软骨肉瘤没有作用。
脊索瘤起源于胚胎残余脊索,在老年人中更常见。对传统方法可切除的患者或软骨样脊索瘤而言,广泛切除加或不加放疗是骶骨和脊柱脊索瘤主要治疗选择,而囊内切除加或不加放疗是颅底脊索瘤的选择。辅助放疗可以考虑被用于巨大侵袭性肿瘤或术后手术切缘阳性时。对任何位置不可切除的脊索瘤,放疗是患者的主要治疗选择。全身治疗(单独或联合手术或放疗)被推荐用于复发性肿瘤患者。去分化脊索瘤通常在软组织肉瘤NCCN治疗指南中描述。
尤文氏肉瘤主要发育在儿童和年轻成人。EWS-FLI1融合T(11;22)染色体易位产生的基因是多数患者的细胞遗传学异常。多药化疗是首选治疗方法,对化疗有效的患者采用局部控制治疗(广泛切除、局部放疗联合化疗、特定人群的截肢),然后行辅助化疗。所有患者无论手术切缘均应在广泛切除或截肢术后行辅助化疗。进展期的肿瘤最合适的治疗方法是放疗加或不加手术,然后行化疗或最佳支持治疗。
骨巨细胞瘤是最常见的良性骨肿瘤,好发于青年人。对可切除肿瘤,囊内刮出术加或不加辅助手段是一个合适的初次治疗方法。对于可切除病灶并能接受复发率或不可切除的轴向病变可采用连续栓塞、地诺单抗、干扰素、聚乙二醇干扰素来作为主要治疗手段。指南推荐在地诺单抗有效的情况下可持续使用地诺单抗直到肿瘤进展。
骨肉瘤好发于儿童和青年,对于低恶性骨肉瘤患者首选扩大切除,对于高度恶性骨肉瘤患者建议术前化疗,然后行扩大切除。对骨膜病变的患者化疗优于扩大切除。低度恶性骨膜骨肉瘤患者病理检查发现为高度恶性,扩大切除术后应该行术后化疗。对复发或难治性骨肉瘤患者推荐采用二线化疗方案,进展期疾病患者可选择手术、姑息性放疗或支持治疗。对于转移灶可切除的患者扩大切除术前应行化疗。转移性疾病的患者的可选择化疗或转移灶切除。
坚持NCCN理念,我们鼓励患者参加精心设计的临床实验来实现进一步发展。


 京公网安备11010502051256号
京公网安备11010502051256号